您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-08 18:55
一、基本概况
1、自然环境
越南位于中南半岛东部,北与中国接壤,西与老挝、柬埔寨交界,东面和南面临南海。国土面积为329556平方公里。海岸线长3260多公里。地处北回归线以南,属热带季风气候,高温多雨。年平均气温24℃左右。年平均降雨量为1500~2000毫米。北方分春、夏、秋、冬四季。南方雨旱两季分明,大部分地区5~10月为雨季,11月至次年4月为旱季。
2、人口和行政区划
越南人口为1.003亿(2023年),有54个民族,京族占总人口86%,岱依族、傣族、芒族、华人、侬族人口均超过50万。主要语言为越南语(官方语言、通用语言、主要民族语言)。主要宗教:佛教、天主教、和好教与高台教。
全国划分为58个省和5个直辖市。首都为河内(Ha Noi),面积3340平方公里,人口805万人(2019年)。河内夏季平均气温28.9℃,冬季平均气温18.9℃。
3、2024年出口概况
2024年1-10月,中国向越南出口医疗器械总计约70.31亿元人民币,同比增长13.17%。
二、监管机构和法规要求
卫生部(Ministry of Health,MoH)下属的医疗设备和建设部(Department of Medical Equipment and Construction,DMEC)负责越南的医疗器械产品注册。越南医疗器械注册需要遵循<第98/2021/ND-CP号法令 医疗器械管理法令>法规要求。
◆ 主要法规:
1.Decree No. 98/2021/ND-CP
- 第98/2021/ND-CP号法令 医疗器械管理法令
2.Circular No. 05/2022/TT-BYT
- 第05/2022/TT-BYT号通告 第98/2021/ND-CP号法令若干条款的执行情况
3.Decree No. 07/2023/ND-CP
- 第07/2023/ND-CP号法令 第98/2021/ND-CP号法令若干条款的修订和补充
4.Decree No. 111/2021
- 第111/2021号法令 关于标签的第43/2017/ND-CP号法令的修正和补充
三、医疗器械定义
◆ 医疗器械:医疗设备是指同时满足以下要求的器械、植入物、仪器、材料、试剂和体外校准品、软件:
a) 根据医疗设备所有者的指定,单独或相互组合使用,为人类服务,用于以下一个或多个目的:
- 诊断、预防、监测、治疗和缓解疾病或补偿伤害;
- 检查、替换、纠正或支持解剖和生理过程;
- 支持或维持生命;
- 控制受孕;
- 医疗设备灭菌;
- 通过检测人体标本,为诊断、监测和治疗提供信息;
b) 未在人体内或人体外运用药理学、免疫学或代谢机制,或者如果使用这种机制,只能使用支持的性质来实现条款中规定的目的。
◆ 体外诊断试剂:体外诊断器械(体外诊断医疗设备),包括试剂、试剂成分、校准品、对照品、试验工具、仪器、器具、设备或系统以及参与支持程序测试的其他产品,根据所有者的指定单独或组合使用,对人体内提取的样本进行体外检查。
特殊备注:
个人专用医疗设备是根据医生的处方专门制造的医疗设备,具有独特的设计特征,仅供特定个人使用。
配件是指医疗器械所有者为特定目的指定的产品,与特定医疗器械结合使用,以促进或协助完成器械的预期用途。
四、产品分类
◆ 分类依据:
第98/2021/ND-CP号法令,医疗器械管理法令 Chapter II
◆ 分类:
根据与医疗器械技术设计和制造相关的潜在风险水平,医疗器械可分为4类:
1)A类医疗器械属于低风险医疗器械
2)B类医疗器械属于中低风险医疗器械
3)C类医疗器械属于中高风险医疗器械
4)D类医疗器械属于高风险医疗器械
五、注册流程
1、注册流程解读
第98/2021号法令将进口许可和上市许可合并,即只要申请上市许可,无需申请进口许可。
医疗器械(包括IVD)可以将产品分组并注册为一个申请,以获得一个医疗器械注册证书:A类和B类产品获得适用标准通知,C类和D类产品获得流通注册证书(产品许可证)。
A类和B类器械需经过卫生部省级办公室监督的通知程序(Notification process)。A类和B类医疗器械注册申请必须通过在线门户上传到当地卫生部门。批准后,将发布适用标准通知。这具有终身有效性。
第30/2015号通知中列出的C类和D类器械在越南进口和销售之前需要市场授权(MA)许可证。所有C类和D类医疗器械注册申请必须通过在线门户提交给DMEC。经批准后,将颁发《流通注册证》(产品许可证)。《流通注册证》(产品许可证)没有有效期。
医疗器械制造商必须指定并授予越南当地注册公司授权书,以提交注册申请并担任注册持有人。根据新规定,注册持有人可以授权不限数量的分销商根据MA许可证进口,以及参与公开招标。
2、注册流程

3、注册提交技术文件


4、注册周期及费用
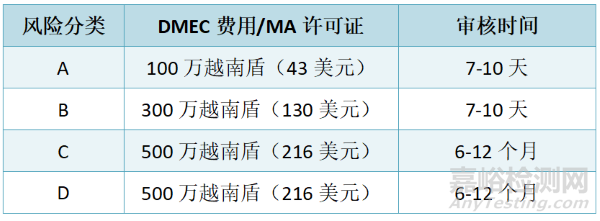
没有参考国家的批准或不符合国家标准的C类或D类产品注册申请将需要进行可能长达90天的技术审查。具有参考国家批准或国家标准的产品将避免技术审查,并在大约10个工作日内获得批准。
5、现场审核要求及注意事项
B、C和D类设备需要进行质量体系符合性评估,可通过ISO 13485:2016证书进行验证。
6、该区域有关UDI的要求
目前暂未实施UDI。

来源:广东省医疗器械管理学会


