您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-26 11:10
一、前言
仿制药是指与原研药具有相同活性成分、剂型、给药途径和治疗效果的替代原料药及其制剂,仿制药应与原研药或参比制剂治疗等效。FDA 在《橙皮书》中规定,治疗等效的仿制药要满足以下5条总体原则:
① 与原研产品具有一样的安全性和有效性。
② 药学等效。
③ 生物等效(且药品本身不存在生物等效实验方法学的问题,或虽有问题但不影响生物等效的结果判定)。
④ 适当的说明书。
⑤ 按照 cGMP 的要求组织生产。
2016年3月5日,CFDA转发了国务院办公厅发布的《关于开展仿制药质量和疗效一致性评价的意见》,意味着一致性评价的大幕已正式拉开。随着药品审评审批制度的改革及流程的优化,仿制药一致性评价申请触发的研制生产现场检查工作也有了大幅地变化。
二、现场检查工作程序
在《总局关于调整药品注册受理工作的公告》(2017 年第134 号)发布以前,仿制药注册申请由各省局受理,并由省局进行药学研制现场和生产现场检查后转入药品审评中心进行审评(如图1)。自2017 年12 月1 日集中受理实施后,根据药品技术审评中的需求,由食品药品审核查验中心(以下简称“核查中心”)统一组织全国药品注册检查资源实施现场核查(如图2)。
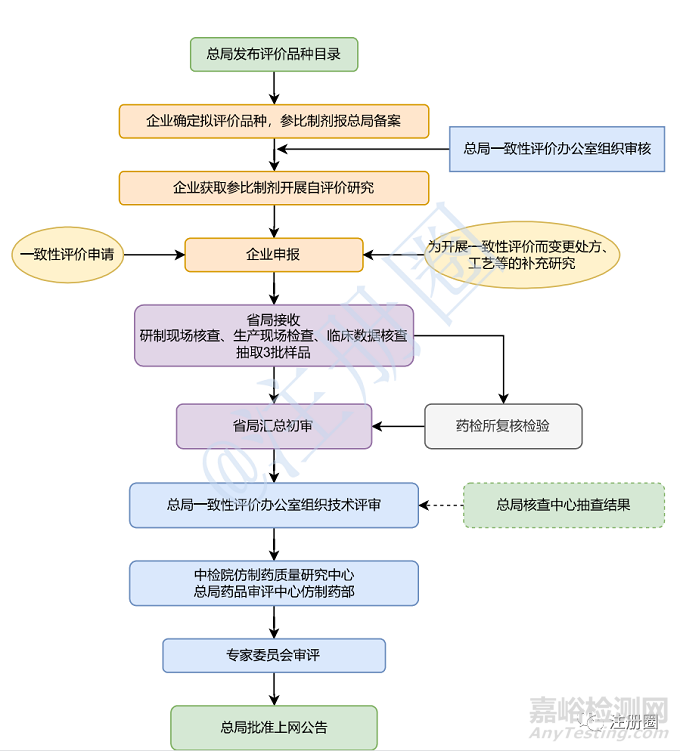
图1 仿制药一致性评价工作程序(逢审必查)
2016年5月26日,《总局关于发布仿制药质量和疗效一致性评价工作程序的公告》(2016年第105号)发布,规定国产仿制药由省级食品药品监督管理部门负责本行政区域内一致性评价资料的接收和相关补充申请资料的受理,组织研制现场核查和生产现场检查,现场抽取连续生产的三批样品送指定的药品检验机构进行复核检验。完成上述工作后,由省级食品药品监督管理部门汇总报送一致性评价办公室。
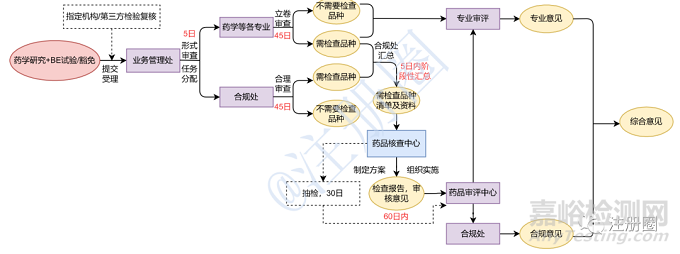
图2 仿制药一致性评价工作程序(基于审评、风险需要)
2017 年8 月25 日,《总局关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100 号)发布,要求一致性评价申请受理后,药品审评中心于45日内对申报资料进行立卷审查,并根据立卷审查和风险评估情况提出有因检查和抽检的需求;药品审评中心设立合规办公室,协调有因检查、抽检以及审评等相关环节;核查中心组织对研制现场、生产现场或临床试验数据的有因检查或抽样。
由此可见,仿制药一致性评价现场检查工作由原先的“逢审必查,串联程序”调整为“基于审评需要”,再到2020年版的《药品注册管理办法》规定的“基于风险启动,并联开展”,现场检查工作程序日渐科学合理。
三、现场检查工作流程
2022年1月1日起施行的《药品注册核查工作程序(试行)》规定,药品审评中心基于技术审评需要,启动药品注册现场核查,申请人在接收到药品审评中心发出的《注册现场核查通知》后,需登录核查中心药品注册申请人之窗,填报相关资料,并做好迎检准备,配合完成现场检查工作。
3.1、现场检查的确认(填报)
法规要求:《关于化药仿制药质量和疗效一致性评价注册申请开展药学研制和生产现场检查有关事项的通告》(2020年第4号)
线上填报:《仿制药质量和疗效一致性评价品种研制生产情况申请表》(以下简称《申请表》)
其他附件:需上传药品GMP证书、药品生产许可证复印件、《现场主文件》、《现场检查准备情况》(模板见“2017年第77号”)
纸质递交:打印《申请表》及其附件3份,加盖申请人公章
3.2、迎检准备
法规要求:《企业指南:仿制药质量和疗效一致性评价药学研制现场检查要求》、《企业指南:仿制药质量和疗效一致性评价生产现场检查要求》
表1 仿制药一致性评价研制生产现场检查准备清单
|
迎检准备 |
研制现场核查 |
生产现场检查 |
|
首次会议企业汇报资料 (PPT) |
1. 药品研制/生产基本情况 (如属委托,应说明被委托研究单位基本情况) |
|
|
2. 一致性评价工作所涉及的所有药品生产批次(含BE批、工艺验证批)生产的地址、生产线、批量、生产时间、地点、使用量和剩余量等 |
||
|
3. 一致性评价所涉及的所有生产批次(含BE批、工艺验证批)所用处方、生产工艺、原辅料、包装材料来源及标准、生产线(设备设施)、产品质量标准(含中间控制标准)等是否与已上市/拟上市商业化生产规模的批次一致 |
||
|
4. 参比制剂的来源、采购和使用情况 |
||
|
5. 药品和参比制剂体外研究的对比情况,包括时间、批号和结果 |
||
|
6. 药品关键质量属性(含稳定性)变化情况 |
||
|
7. 质量体系风险情况:包括品种风险,工艺风险及设备风险等 |
||
|
— |
8. 质量体系运行情况:组织机构和质量管理简介,药品GMP执行情况,近3年药品GMP检查缺陷整改情况 |
|
|
— |
9. 商业批生产线的设备、设施、生产规模情况,与其他品种共线生产情况及风险评估的结果 |
|
|
— |
10. 检查品种动态生产安排情况 |
|
|
迎检准备 |
研制现场核查 |
生产现场检查 |
|
文件资料 (原始文件或原始文件的真实拷贝) |
注册申报资料(全套) |
|
|
委托研究协议和质量协议(如有) |
委托生产协议和质量协议(如有) |
|
|
参比制剂的来源及证明 包括: 1. 购买发票、赠送证明等 2. 参比制剂的包装标签、说明书、剩余样品等 3. 参比制剂的接收、发放、使用记录或凭证 |
||
|
关键仪器设备 包括名称、型号、内部编号及所在位置信息等 |
||
|
溶出度仪的验证资料 |
||
|
一致性评价工作所涉及的产品的体外评价资料 体外研究报告内容至少包括研究时间,研究批次,研究项目,结果对比,结论等 |
||
|
一致性评价工作所涉及产品的剩余样品情况(不应销毁) |
||
|
药品相关研究记录 包括: 1. 处方工艺研究原始记录(如有) 2. 样品试制相关原始记录 3. 质量研究相关原始记录 4. 体外评价及稳定性研究的相关原始记录 5. 仪器设备使用记录 6. 纸质图谱和/或电子图谱 |
药品生产相关规程 包括: 1. 生产工艺规程(若处方工艺未变更,还需提供根据最近一次批准的注册申请制定的生产工艺规程) 2. 标准操作规程(产品相关生产操作规程、设备操作规程、原辅料取样检验操作规程) 3. 原批准的质量标准和申报的质量标准 4. 空白批生产记录(批生产主记录) |
|
|
药品检验方法确认或验证资料 |
工艺验证方案和报告,以及设备确认、清洁验证情况 |
|
|
稳定性试验方案及报告 |
— |
|
|
一致性评价工作所涉及的所有生产批次(含BE批、工艺验证批等) 1.相关记录,包括:批生产记录、批检验记录、稳定性试验记录、仪器设备使用记录、纸质图谱和/或电子图谱 2. 原辅料、内包材供应商档案 3. 物料台账及相关单据 |
||
|
接受现场检查品种: 1. 近3年的年度质量回顾报告 2. 生产线近3年接受境内外检查机构检查情况及整改资料 |
||
|
注意:申请人应尽可能将不同场地的纸质文件(包括原始记录)集中,以便查阅 |
||
|
迎检准备 |
研制现场核查 |
生产现场检查 |
|
人员要求 |
药品研制总负责人、关键试验项目研究负责人、研究人员、样品试制、样品检验人员;研究机构质量保证负责人和相关人员 |
生产过程所涉及的生产、检验、质量保证相关人员、企业质量负责人 |
|
药品注册负责人 |
||
|
熟悉检测设备各项功能并具备系统管理权限的人员 |
||
|
原材料、样品、参比制剂各类原始记录、档案资料、票证凭据等的保管人员、财务人员 |
||
3.3、配合检查及后续工作
申请人收到现场核查通知后,如涉及动态生产现场检查的,应及时排产;收集备查的纸质文件,提前对文件资料的内容熟知,以便能及时找出核查老师需要的文件资料;保证检查中相关人员到位,并做好核查老师的接待工作。现场检查结束后,申请人应按通知书要求送检;跟踪检验机构结果,及时沟通。
四、现场核查要点
依据《总局关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等4个指导原则的通告》(2017年第77号),仿制药一致性评价研制生产现场检查的基本要求是,真实性、一致性、数据可靠性及合规性。
研制现场核查的目的是对药学研究情况(包括处方与工艺研究、样品试制、体外评价等)进行实地确证,对原始记录进行审查,确认申报资料真实性、一致性和数据可靠性,以及研制过程合规性的过程。


图3 仿制药一致性评价研制现场核查要点
生产现场检查的目的是对申报品种的生产条件和能力及其动态生产过程进行检查,确认相关生产和质量控制活动与申报的处方、生产工艺、生产条件、质量标准的一致性,以及药品生产是否符合《药品生产质量管理规范》要求。
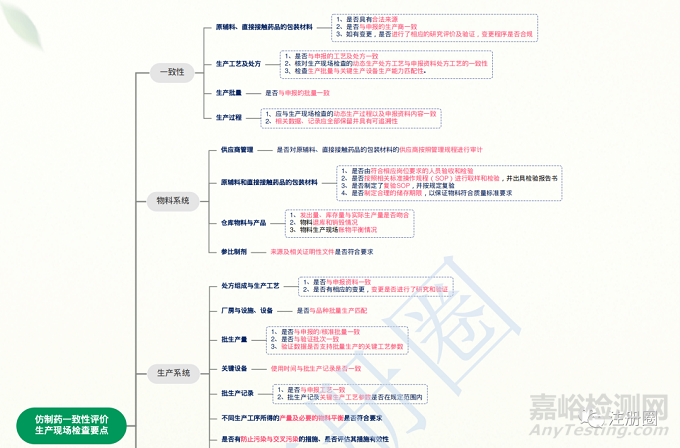
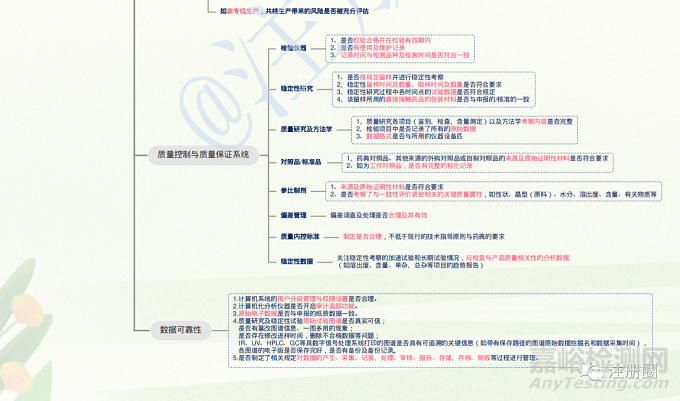
图4 仿制药一致性评价生产现场核查要点
五、现场检查判定原则
表2 仿制药一致性评价研制生产现场检查结果判定
|
核查结论 |
判定原则 |
|
|
研制现场核查 |
生产现场检查 |
|
|
“通过” |
未发现真实性问题、且与申报资料一致的 |
|
|
“不通过” |
发现真实性问题 |
|
|
存在与申报资料不一致 |
||
|
存在严重的数据可靠性问题的 |
||
|
缺少原始记录导致无法溯源 |
||
|
不配合检查,导致无法继续进行现场检查 |
||
|
— |
生产过程严重不符合《药品生产质量管理规范》 |
|
参考来源
[1] 浅谈仿制药质量一致性评价 https://zhuanlan.zhihu.com/p/129737945
[2] 仿制药一致性评价现场检查工作进展及新法规下药品注册核查的思考.《中国食品药品监管杂志》
https://ypjd.cbpt.cnki.net/WKE3/WebPublication/paperDigest.aspx?paperID=856671dd-f0e1-4c28-86d4-f3d859706b0c

来源:注册圈