您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-09-02 21:28
截止8月26日全球已发现4.7万猴痘感染病例。这次猴痘的全球爆发,第一个病例是5月7日在英国被发现,随后5月14日在英国又发现两例,目前已漫延到99个国家和地区。
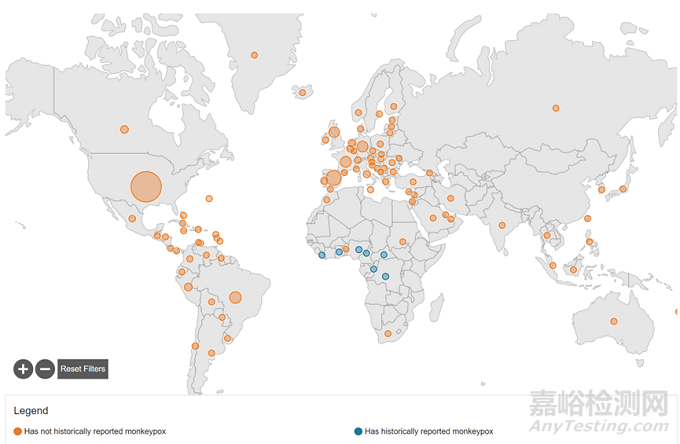
▲蓝色是曾经发生过猴痘的国家 橙色是本次猴痘爆发的国家
美国于5月17日发现了第一例猴痘病例,到8月26日全美已有17,432个确诊病例。从下图可以看到美国猴痘疫情已经成指数增长了,并且已经波及全美50个州了。其中,加州已经确诊了3,291个病例,为全美确诊病例最高的州,纽约州也达到了3,124个病例,佛罗里达州、佐治亚州和德州累计猴痘确诊病例也都超过1,000例了。
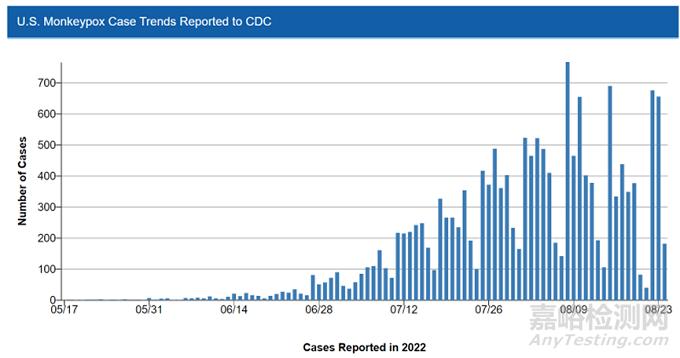
▲美国猴痘确诊病例数据图表
图片来源:美国疾控中心
01美国猴痘检测市场需求分析
5月17日,美国马萨诸塞州报告了美国第一个猴痘病例。参考2003年猴痘在美国小范围爆发的经验,美国白宫面对本次出现的猴痘病例表现得很有信心。当时美国政府已经囤积了2,400剂的Jynneos猴痘疫苗,并且在5月底额外订购了7.2万剂Jynneos猴痘疫苗。
美国政府从新冠抗疫中学到了一个重要的教训,就是普及疫苗接种的重要性。但是因为疫情爆发的规模超出了预期,目前美国以及全球出现了猴痘疫苗紧缺的情况。上周六白宫和CDC关于猴痘紧急会议的主要议程就是如何更有针对性的给潜在感染人群发放疫苗。
美国猴痘抗疫策略重疫苗,轻检测。
美国猴痘疫情爆发成全球确诊病例最高的国家,与其检测量低有相当大的关系。虽然早期全美猴痘检测量看似有能力覆盖疑似人群,但是实际检测的人数并不多。较低的检测量让美国似乎赤裸地面对着猴痘病毒,因此无法将这些患有猴痘的病例隔离开来,只能“任由”其传播给其他人。那为什么美国政府在猴痘检测布了那么多局,却无法阻止猴痘在全美的散播呢?
其实,FDA在很短时间就批准了一个CDC的猴痘检测(Non-variola Orthopoxvirus )核酸试剂,并且让5家商业实验室加入LRN网络,包括Aegis Science, Labcorp, Mayo Clinic Laboratories, Quest Diagnostics and Sonic Healthcare,使用FDA批准的这个猴痘测试开展检测。在6月30日时美国至少有67个实验室可检测猴痘病毒,并且每周可检测8,000次。但华盛顿邮报表示,从5月17日至6月30日,LRN实验室的实际检测量只有2,009个样本,完全没有达到通过检测控制病毒传播的效果。
猴痘检测在美国没有很快开展的原因主要有4点:
第一,美国政府目前流程要求猴痘病患的标本必须送往美国Laboratory Response Network(LRN)网络,然后才能送往疾病控制和预防中心,检测者还必须有他们的家庭医生出具的处方才可以进行检测。
第二,猴痘病毒致死率低,传播速度也不及新冠病毒那么快(猴痘的基本传染数R0在0.6-1.0,而新冠病毒变异株奥密克戎的R0在7左右),美国政府在早期预测猴痘并不会传遍全国,再加上政府疲于应对新冠疫情、枪支管理、堕胎法案等议题,因此对猴痘并未特别重视。
第三,由于卫生部门对于猴痘症状的普及教育还不够充分,这给医生单从症状来判断带来了一定的挑战。诊所对于患者检测的要求也高,在他们表现了1-2个临床症状才愿意提供猴痘检测。
第四,以前被感染的人群以同性恋人群为主,这就是为什么加州和纽约州的确诊数量较高的原因,他们前往检测的意愿不高。针对大部分感染上猴痘病毒或者疑似感染上猴痘病毒的同性恋人群,他们心理负担主要包括:我或许会成为一个在社会上不受欢迎的人;我与男性发生性关系;我有多个性伴侣;或者我没有使用保护措施。
根据目前猴痘快速传播的速度,美国CDC和FDA正在调整猴痘的检测策略,拜登政府在8月4日宣布猴痘疫情为一个公共紧急卫生事件后,猴痘的每周检测量上涨幅超过50%。FDA在7月15日的猴痘安全性通讯上表示,鼓励各实验室使用CDC研发的猴痘相关产品、其它试剂和自动化流程,以提高美国实验室的检测能力。同时随着美国政府逐渐对猴痘疫情的重视,猴痘的检测能力从8,000次/周快速涨到了80,000次/周。
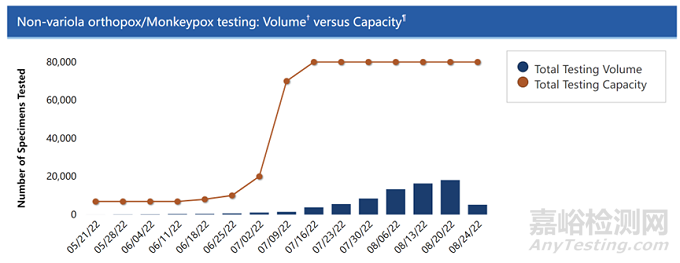
▲美国猴痘检测能力和全国检测量
图片来源:美国疾控中心
美国有约400万人的庞大男同性恋群体,1900万的同性恋群体(LGBT),这是目前猴痘传播最大的人群。如果美国猴痘检测推广不能尽快扩大,则疫情传播将更加势不可挡,有可能重蹈美国早期对抗新冠的覆辙。另外,从科学的角度目前还不能解释为什么猴痘会在同性恋人群中更快的传播,如果非同性恋群体的猴痘传播速度也提高了,美国猴痘疫情将进一步的失控。
美国当下的猴痘检测能力看似很充分,但是还是存在很多问题,包括费用的支付,家庭医生的参与等。这些问题不解决,无法很快扩大猴痘的检测。
在猴痘疫情爆发的最初几周,美国联邦政府承担了一部分检测、治疗和疫苗接种费用,但这有可能在未来会有变化。目前,在公共卫生实验室或疾控中心进行的猴痘检测不会对个人产生任何费用,但是个人若通过商业实验室进行猴痘检测,可能会需要支付相关的测试费用,实际金额由医保范围确定。而那些没有医疗保险的个人有可能检测意愿更低。
美国政府需要在未来出台一些措施来让猴痘检测更具有普及性。
02猴痘检测试剂FDA最新政策
对于已经开发了猴痘检测试剂的中国企业来说,大家最关注的是什么时候FDA会开始批准美国猴痘检测试剂的注册。
FDA于8月24日Virtual Town Hall线上会议上称暂时还没有猴痘检测试剂EUA的计划,但是宣布可以接受猴痘试剂Pre-EUA的申请,不过需要制造商提供相应的资料,包括临床计划以及实验室的功能数据。对于实验室的功能数据,根据过往经验,FDA需要使用真实灭活猴痘病毒。
对于想进入美国猴痘检测市场的中国企业,第一个选择是尽快申请Pre-EUA, 第二个选择是申请州政府的LDT批准。
LDT(Laboratory-developed test)是由实验室开发的并在单独实验室使用的体外检测试剂,它的批准一般由每个州的卫生部来审核和批准。
最近因为纽约州的猴痘疫情比较严重,位于纽约的Applied DNA Clinical Labs (ADCL) 于
8月向纽约州的卫生部(NYSDOH)递交了他们Linea V1.0猴痘PCR检测试剂的LDT申请,目前正在等待纽约州卫生部的批准。
03欧洲猴痘检测市场分析和CE认证
本次猴痘的全球大流行起源于英国,最初在欧洲各国蔓延,再传播到美国和其他国家。
世卫组织(WHO)的Ghebreyesus博士在8月25日的一个采访中说:“这次猴痘大流行的早期爆发是在欧洲,美洲只有少量的病例。但是这个趋势已经倒过来了,现在美洲的患病人数是60%,而欧洲只有40%了。”
根据欧盟CDC 8月24日的数据,欧洲有21,098猴痘案例分布在43个欧洲地区国家,下图是前10个感染最多的国家,主要是西班牙,英国,德国,法国和荷兰。
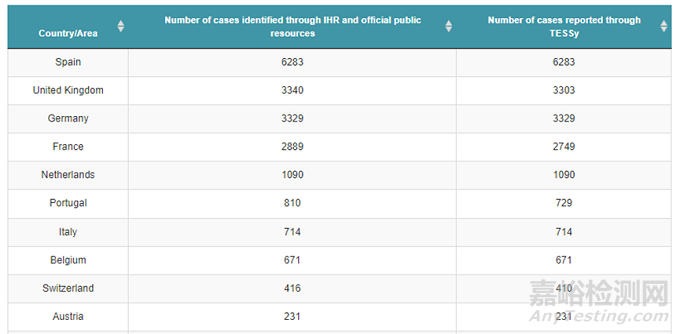
从人口的角度来说,欧洲的人口总数7.46亿是美国的2倍多,同性恋(LGBT)的比例和美国差不多5-7%之间(美国是5.6%)。从传染人数来看,欧洲的人数目前开始低于美国,这也许说明猴痘全球爆发的峰值可能已经过了。
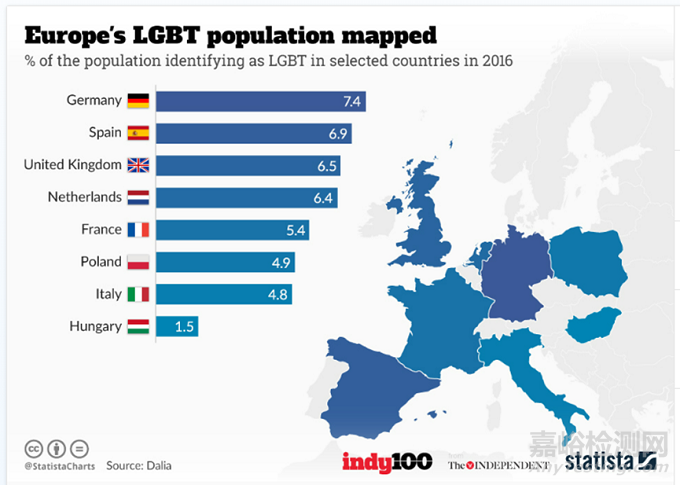
欧洲的猴痘检测市场和美国完全不一样,因为在美国目前只有FDA指定的一个由CDC生产的猴痘检测试剂,而在欧洲,有超过100家的企业已经通过DOC(自我声明)的方式获得了猴痘检测试剂的CE认证,可以在欧洲进行销售,其中大部分是中国的IVD企业。
因为猴痘检测试剂在今年5月26日刚刚结束的IVDD法规里是属于Other 分类,所以不需要NB机构的认证,只要通过企业自己的DOC方式就可以声称获得CE认证。
猴痘的疫情发生在5月26日前,大量的IVD企业利用IVDD法规最后有效的几天时间申请了CE。
对于欧洲国家来说,目前最大的挑战就是无法分辨这些IVD企业猴痘检测试剂的质量,因为它们都没有经过第三方实验室和临床的验证。他们选择猴痘试剂企业的唯一办法就是使用大公司或者有合作历史的IVD头部企业。
体外诊断大佬罗氏也是抢在5月26日之前给它的三款猴痘检测试剂申请了DOC的CE认证。第一个检测试剂和美国CDC的一样,可以检测任何正痘病毒(orthopoxvirus)包含了牛痘,天花和猴痘等,第二个检测试剂是只针对猴痘的检测试剂,可以检测2种主流的猴痘变异株。第三个产品是以上两个试剂的合成。根据罗氏的财务预测,它的新冠业务今年会下跌,而猴痘检测试剂收入将可能成为罗氏今年下半年的热卖产品。
对于广大的中国IVD企业如何在欧洲市场和罗氏这样的行业巨头争夺猴痘检测试剂市场,唯一的方法就是尽快完成在欧洲或者是美国的临床数据,以及第三方实验室的功能数据。当然有实力的企业也可以考虑IVDR下的NB认证,不过整个流程周期会非常长。
04中国猴痘检测试剂市场和注册指南
和美国欧洲相比,中国猴痘检测试剂注册的步伐走的最快,在一个猴痘病例都没有发现的情况下,就于7月15日公布了猴痘核酸检测试剂的注册指南 – “猴痘病毒核酸检测试剂技术审评要点(试行)”。
从市场需求的角度,虽然中国目前还没有一例猴痘感染病例,但是根据国家对抗新冠的策略,清零一定是必须的。如果保持零感染,就必须把猴痘病毒挡在国门外,所以当务之急就是立刻审核和批准中国的猴痘检测试剂,然后对于海外进入中国的每个人甚至货物进行猴痘病毒的检测。
这是一个巨大的需求,根据最新的出入境数据,每个月进入中国的人数在700-800万人次。国家器审中心在这么快的时间就发布猴痘病毒核酸检测试剂注册指南的原因,也是希望有IVD企业能够尽快拿到注册。
因为无法在国内进行猴痘的临床实验,很多国内的IVD企业都在寻找美国或者欧洲进行临床实验和实验室功能性检测的资源。
考虑到未来美国猴痘检测试剂的EUA注册会很快放开,对于IVD企业来说,最好的选择就是在美国做临床,这样一个临床实验可以同时用到中国药监和美国FDA的注册,甚至欧洲IVDR的注册。

来源:霍普金斯MedTech欧美资讯


