您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-09 10:56
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.恒瑞KRAS G12D抗肿瘤新药上Ⅰ期临床。恒瑞医药1类化药HRS-4642注射液登记启动一项Ⅰ期临床,评估用于KRAS G12D突变、晚期实体瘤治疗的安全性、耐受性和药代动力学。HRS-4642注射液通过抑制肿瘤细胞增殖以发挥抗肿瘤作用。与 KRAS G12C是非小细胞肺癌(NSCLC)患者中最常见的KRAS突变不同,KRAS G12D是结直肠癌和胰腺癌中最常见的突变。目前全球尚无同类药品进入临床。
2.礼来Aβ单抗在华启动Ⅲ期临床。礼来Aβ单抗donanemab注射液在中国登记启动一项国际(含中国)Ⅲ期临床,旨在存在脑tau蛋白病理的早期症状性阿尔茨海默病(包括阿尔茨海默病所致的轻度认知障碍以及轻度阿尔茨海默病)受试者中评估donanemab的安全性和有效性。试验的中国部分由首都医科大学宣武医院贾建平主任医师担任主要研究者,拟在中国近50家研究中心开展,目标入组人数为400人。
3.沃森九价HPV疫苗启动Ⅲ期临床。沃森生物旗下泽润生物自主研发的九价HPV疫苗登记启动一项Ⅲ期临床,与市售九价人乳头瘤病毒疫苗(酿酒酵母)比较,评价用于0、2、6月免疫程序接种于16-26岁女性的免疫原性。在已完成的Ⅰ期临床结果显示,该疫苗具有良好的安全性和免疫原性。值得一提的是,沃森生物的双价HPV疫苗已于今年3月获NMPA批准上市,商品名为沃泽惠。
4.熙源安健CED疗法获FDA孤儿药资格。熙源安健开发的TGF-β靶向小分子耦合药物BR007获FDA授予孤儿药资格,拟用于治疗进行性骨干发育不良(CED)。进行性CED是一种罕见的常染色体显性遗传骨病,由染色体19q13上的转化生长因子TGF-β基因突变引起。目前进行性骨干发育不良的治疗主要依靠止痛和症状管理,尚无有效的治疗方法来挽救患者的病情进展。
5.应世FAK抑制剂上卵巢癌II期临床。应世生物FAK抑制剂IN10018治疗铂耐药复发卵巢癌的关键II期临床首例患者给药。该项研究旨在评估IN10018联合聚乙二醇脂质体多柔比星(PLD)对比安慰剂联合PLD治疗铂耐药复发卵巢癌的有效性和安全性,由中国医学科学院肿瘤医院吴令英主任牵头开展。公布于ASCO 2022年会上的一项Ib期临床显示,IN10018达到56.7%的客观缓解率(ORR)和86.7%的疾病控制率(DCR)。
6.烨辉引进CD74-ADC获批临床。烨辉医药从Sutro Biopharma公司引进的CD74靶向ADC药物BN301(STRO-001)获国家药监局临床默示许可,拟开发用于治疗血液系统恶性肿瘤经治患者。STRO-001目前正在美国、以色列和韩国开展Ⅰ期剂量爬坡临床试验。该新药用于治疗多发性骨髓瘤已获FDA授予孤儿药资格。烨辉拥有BN301在大中华区开发和商业化授权,用于治疗血液癌症患者,包括非霍奇金淋巴瘤、多发性骨髓瘤和白血病。
国际药讯
1.吉利德CAR-T新适应症获欧盟批准。欧盟委员会(EC)批准吉利德旗下Kite公司CAR-T疗法Tecartus(brexucabtagene autoleucel)第2项适应症,用于治疗26岁及以上成人复发或难治性B细胞前体急性淋巴细胞白血病(ALL)。在I/II期研究ZUMA-3中,中位随访为26.8个月时,Tecartus达到71%的完全缓解(CR)率。所有患者的中位总生存期为25.4个月,而达到CR患者的中位总生存期约为47个月。Tecartus的安全性与既往研究一致。
2.“渐冻症”创新疗法获FDA专家推荐。FDA外周和中枢神经系统药物咨询委员会(PCNS)推荐Amylyx公司创新疗法AMX0035(苯丁酸钠和牛磺酸二醇口服固定剂量配方)上市,用于治疗肌萎缩侧索硬化(ALS)患者。在一项Ⅱ期临床CENTAUR中,与安慰剂组相比,AMX0035治疗组24周后患者的ALSFRS-R评分下降幅度显著减少,患者的中位生存期延长4.8个月。在加拿大,该新药已获批有条件上市,用于治疗ALS患者。
3.吉利德TROP2-ADC乳腺癌Ⅲ期临床OS数据公布。吉利德科学TROP2靶向ADC新药Trodelvy(sacituzumab govitecan)在ESMO2022大会上公布用于治疗接受过多种前期治疗的HR+/HER2-转移性乳腺癌的Ⅲ期临床(TROPiCS-02)总生存期(OS)数据。与化疗对照组相比,Trodelvy治疗组患者的总生存期(OS)显著改善,两组的中位OS分别为14.4与11.2个月(HR:0.79,95% CI:0.65-0.96,p=0.02)。另一项关键次要终点客观缓解率(ORR)也显示Trodelvy表现优于对照组。吉利德已向FDA递交该新药的sBLA申请。
4.阿斯利康ASO疗法Ⅲ期临床成功。Ionis公司与阿斯利康联合开发的反义寡核苷酸(ASO)疗法eplontersen,在治疗遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性多发性神经病(ATTRv-PN)的Ⅲ期临床达到共同主要终点与次要终点。eplontersen治疗35周时,患者血清TTR较基线下降81.2%(p<0.0001);患者mNIS+7评分自基线的改变百分比与安慰剂组相比也具有显著性改善。Eplontersen的安全性与耐药性良好。两家公司计划今年向FDA提交新药申请(NDA)。
5.创新青光眼植入疗法Ⅲ期临床积极。Glaukos Corporation公司前列腺素类似物travoprost新配方iDose TR通过微创手术植入治疗青光眼的两项Ⅲ期临床(GC-010和GC-012)达到主要终点。与一天两次青光眼药水0.5% timolol相比,接受快速与慢速释放的iDose TR治疗的患者眼内压的下降均达到非劣效性标准,两个试验中iDose TR治疗组和对照组的眼内压下降水平分别有6.6-8.5和6.6-7.7毫米汞柱,以及6.7-8.4和6.8-7.2毫米汞柱;而且有81%的慢速释放组患者在一年内可完全停止使用局部降眼压用药。iDose TR总体耐受性良好。Glaukos计划向FDA提交缓释iDose TR的新药申请。
6.KRAS抑制剂组合治疗结直肠癌结果积极。Mirati公司KRAS G12C抑制剂adagrasib治疗KRAS G12C突变、晚期结直肠癌经治患者的最新临床数据积极。研究者评估的adagrasib单药的确认客观缓解率(ORR)为19%,疾病控制率为86%,中位缓解持续时间(DoR)为4.3个月(95% CI,2.3-8.3),中位无进展生存期(PFS)为5.6个月(95% CI,4.1–8.3);adagrasib与cetuximab联用的ORR达到46%,疾病控制率为100%,中位DoR为7.6个月,中位PFS为6.9个月。药物的单药和联合治疗总体耐受性良好。再鼎医药拥有adagrasib在大中华区的开发权益。
7.FDA解除反义RNA疗法的临床暂停。FDA解除了Sarepta公司新一代反义寡核苷酸疗法SRP-5051(vesleteplirsen)用于杜氏肌营养不良症(DMD)的II期临床暂停。今年6月,因为该项试验B阶段有1例患者经历了严重的低镁血症不良事件,FDA叫停了该项临床。在接受补充剂治疗后,患者血清中的镁离子水平恢复正常。目前,Sarepta公司已调整临床试验方案,包括扩大尿液生物标志物的监测。
医药热点
1.全国拟推广“落地检”。在9月8日召开的国务院联防联控机制新闻发布会上,国家卫健委疾控局副局长吴良有表示,在充分借鉴前期部分省份在跨省流动人员疫情防控经验的基础上,疫情防控工作将在国庆假期及前后按照“自愿、免费、即采即走、不限制流动”的原则在全国推行“落地检”。即为跨省流动人员到达当地后立即提供一次核酸检测服务。并要求各地将“落地检”的检查结果及时纳入健康码,方便群众查询检测结果。
2.甘肃公卫医学中心开建。9月7日,甘肃省公共卫生医学中心项目在兰州新区开工建设。甘肃省公共卫生医学中心项目统筹公共卫生中心和应急救治中心两个项目,两个项目同步实施、同时投入使用。项目总建筑面积为17.22万平方米,估算总投资20.41亿元,计划2024年6月底前建设完成。该项目的建设,旨在推进甘肃省级疾控中心现代化发展,填补甘肃省生物安全三级实验室的空白,为开展鼠疫、布病、高致病性禽流感、艾滋病和新冠肺炎等疾病相关的病原体检测研究提供技术平台。
3.首个国产新冠口服药通过医保目录调整初步审查。按照《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》和《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整申报指南》,国家医保局近期对2022年医保药品目录调整的药品申报资料进行了初步形式审查,并公布通过初步形式审查的药品名单及相关信息,名单中显示,首个国产新冠口服药阿兹夫定片已通过国家医保药品目录调整初步形式审查。
评审动态
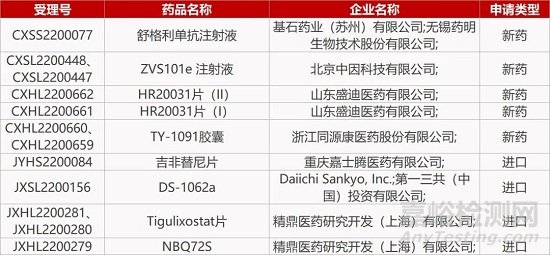
1. CDE新药受理情况(09月08)

来源:药研发


