您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-21 11:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.泽布替尼新适应症获欧盟批准。百济神州BTK抑制剂百悦泽®(泽布替尼)获欧盟委员会(EC)批准新适应症,用于治疗初治(TN)或复发/难治性(R/R)慢性淋巴细胞白血病(CLL)成人患者。在两项Ⅲ期临床【SEQUOIA(NCT03336333)和ALPINE(NCT03734016)】中,无论是与苯达莫司汀联合利妥昔单抗(B+R)相比用于一线CLL治疗,还是与伊布替尼相比用于R/R CLL治疗,百悦泽®均达到优效性。
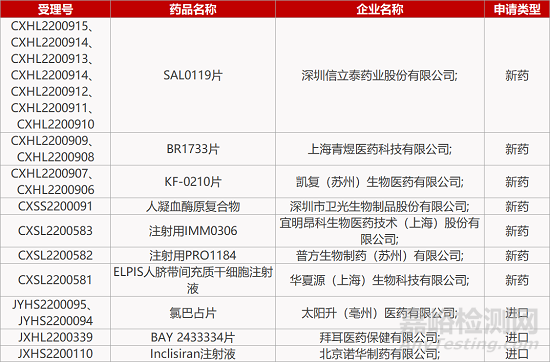
2.诺华长效降脂siRNA疗法在华报产。诺华靶向PCSK9的小干扰核酸(siRNA)疗法inclisiran注射液的上市申请获CDE受理。Inclisiran是全球首个降低低密度脂蛋白胆固醇(LDL-C)的siRNA药物,已于2020年12月率先在欧盟获得批准上市,用于治疗成人高胆固醇血症及混合性血脂异常。一项ORION-3试验结果显示,在他汀基础上,每年两次inclisiran治疗可在4年内有效持续降低LDL-C水平;约80%的患者LDL-C水平达到<70mg/dL。
3.驯鹿CAR-T眼科自免病早期临床积极。驯鹿生物BCMA-CAR-T疗法伊基仑赛注射液(CT103A)治疗视神经脊髓炎谱系疾病(NMOSD)的Ⅰ期(IIT)临床研究成果已获Nature子刊受理。该项研究由华中科技大学同济医学院附属同济医院王伟教授团队开展。分析数据显示,CT103A可降低NMOSD受试者的EDSS(扩展的残疾状态评分量表)评分,可使50%受试者视力改善、67%受试者行走能力改善、75%受试者直肠膀胱功能改善。药物总体耐受性良好。
4.荣昌泰它西普获批IgA肾病Ⅲ期临床。荣昌生物BLyS/APRIL双靶点融合蛋白泰它西普(商品名:泰爱®)获FDA批准,即将在美国开展IgA肾病适应症的Ⅲ期临床。在中国由北京大学第一医院肾内科张宏教授牵头的Ⅱ期临床数据显示,与安慰剂相比,泰它西普(240mg)治疗组24周后受试者尿蛋白水平较基线显著降低,24小时尿蛋白平均水平较基线下降49%(p<0.05);且药物的安全性良好。
5.普方FRα靶向ADC国内报IND。普方生物1类生物制品注射用PRO1184的临床试验获CDE受理。PRO1184是一款靶向叶酸受体α(FRα)的新型ADC药物,已在临床前研究的几种小鼠CDX模型中显示出良好的肿瘤生长抑制活性和良好的治疗窗口。今年8月,该新药在美国获批开展Ⅰ期临床,评估用于晚期癌症(包括卵巢癌、子宫内膜癌、乳腺癌、非小细胞肺癌和间皮瘤)患者的安全性、抗肿瘤活性和药代动力学。
国际药讯
1.全球首款改变1型糖尿病进程疗法获批。Provention Bio创新CD3单抗Teplizumab获FDA批准上市,用于延缓或预防成人及8岁以上人群的临床1型糖尿病(T1D)。这是全球首款改变1型糖尿病疾病进程的疗法。在一项关键II期TN-10研究中,2周疗程teplizumab治疗可将T1D的发病时间平均推迟约3年(中位数为32.5个月)。在中位随访为2.5年时,Teplizumab组有50%的受试者确诊为T1D,而安慰剂组这一数值达到78%。
2.树突细胞疗法胶质瘤III期临床成功。Northwest公司个性化的树突细胞疗法DCVax-L治疗新诊断或复发性胶质母细胞瘤(nGBM/rGBM)的III期研究达到主要终点。在nGBM队列(n=232)中,DCVax-L组患者的中位OS为19.3个月(手术后为22.4个月),对照组为16.5个月(HR=0.80,p=0.002)。在rGBM队列(n=64)中,DCVax-L组患者的中位OS为13.2个月,对照组为7.8个月(HR=0.58,p<0.001)。详细结果已同步发表在《JAMA Oncology》杂志上。
3.武田BCR-ABL1靶向TKI疗法III期临床积极。武田通过收购Ariad公司获得的一款靶向BCR-ABL1的第三代酪氨酸激酶抑制剂(TKI)普纳替尼(Iclusig),在头对头伊马替尼(格列卫)一线治疗新诊断费城染色体阳性急性淋巴细胞白血病(Ph+ALL)患者的III期PhALLCON研究达到主要终点。与伊马替尼相比,普纳替尼联合低强度化疗使患者获得微小残留病(MRD)阴性完全缓解的比例更高,临床中也没有新的安全信号。
4.补体C5抑制剂获FDA眼科突破性疗法认定。IVERIC bio公司补体C5抑制剂Zimura(avacincaptad pegol)获FDA授予突破性疗法认定,用于治疗由年龄相关性黄斑变性引起的地图样萎缩(GA)。GA是由于过量补体活化引起不可逆病变,导致视网膜细胞受损所导致。目前全球尚无GA疗法获批上市。在两项III期临床(GATHER1和GATHER2)中,与假性注射相比,Zimura治疗在基线至12个月内GA面积的平均增长率分别显著降低35%(p=0.0050)与18%(p=0.0039)。
5.Galectin-3单抗治疗AD概念验证临床积极。TrueBingding公司靶向galectin-3的单抗药物TB006在治疗轻度至重度阿尔兹海默病(AD)的Ib/II期概念验证试验达到主要终点和次要终点。TB006旨在通过结合galectin-3使其无法充当胶水,从而减少斑块沉积,恢复神经元之间的交流。结果显示,TB006可改善患者的痴呆症状(p=0.08),其CDR-SB评分变化为-0.44分(p=0.08),与安慰剂组之间的治疗差异为63%。在ITT人群中,患者的临床功能也显示出改善的趋势。
6.再生元与CytomX合作开发新一代双抗。再生元与CytomX公司将利用后者Probody therapeutic平台和生物掩蔽策略,针对再生元双特异性药物,合作开发条件性激活的新一代双特异性癌症疗法。根据协议,CytomX将获得3000万美元的预付款,未来的靶标提名付款,最多20亿美元的研究、开发、监管和销售里程碑付款,以及特许权使用费。再生元将负责资助临床前和临床开发和商业化活动。
医药热点
1.北京一医院“颈动脉斑块逆转管理门诊”开诊。为进一步完善医院医疗服务体系,全面提高医院综合门诊需求,11月11日,“颈动脉斑块逆转管理门诊”于北京天坛普华医院正式开诊。颈动脉斑块逆转管理门诊将组织多学科专家(MDT团队),围绕患者的斑块筛查,斑块风险评估以及逆转和稳定斑块开展工作,将心脑血管疾病治疗关口前移,弥合临床治疗、预防、康复之间的裂痕,最终目标是尽可能减少脑卒中的发生。
2.云南省卫健委副主任姜旭拟任新职。日前,中共云南省委组织部发布省管干部任前公示公告。其中,现任云南省卫健委副主任、党组成员,省中医药管理局局长的姜旭,拟任省直单位正厅长级领导职务。据公开资料,姜旭1965年12月生,大学学历,中共党员,1990年7月参加工作。历任云南省中医管理局副局长,云南省中医管理局常务副局长等职。
3.最新中国医院排行榜发布。11月20日,复旦版《2021年度中国医院综合排行榜》和复旦版《2021年度中国医院专科声誉排行榜》在上海发布。中国医学科学院北京协和医院、四川大学华西医院、中国人民解放军总医院、上海交通大学医学院附属瑞金医院和复旦大学附属中山医院位列《2021年度中国医院综合排行榜》前五名。全国共有100家医院进入“复旦版中国医院综合排行榜”,42个专科(前10名)榜上有名。
评审动态

来源:药研发


