您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2025-01-08 09:44
1、概述
化学药品注射剂被广泛应用于临床,通过静脉或肌肉注射快速进入体循环, 为安全风险较高的剂型,因此必须规范注射剂生产过程的无菌保障。无菌/灭菌 工艺验证是确保产品达到无菌要求的重要步骤。
注射剂的无菌/灭菌工艺包括:以湿热为主的最终灭菌工艺 (Terminal Sterilization Process)和无菌生产工艺 (Aseptic Process)。注射剂的湿热灭菌工 艺包括过度杀灭法(即F₀≥12min) 和残存概率法(即Fo≥8min), 这两种湿热 灭菌工艺都可以在实际生产中使用。
本文参考国家药监局药审中心发布的《化学药品注射剂灭菌和无菌工艺研究 及验证指导原则(试行)》(2020年第53号)和《药品GMP:无菌制剂》, 结合实际工作经验对化学药品注射剂湿热灭菌工艺验证的验证前准备及确认工作、风险评估、灭菌工艺验证过程等实施要点进行阐述。
2、验证前准备及确认工作
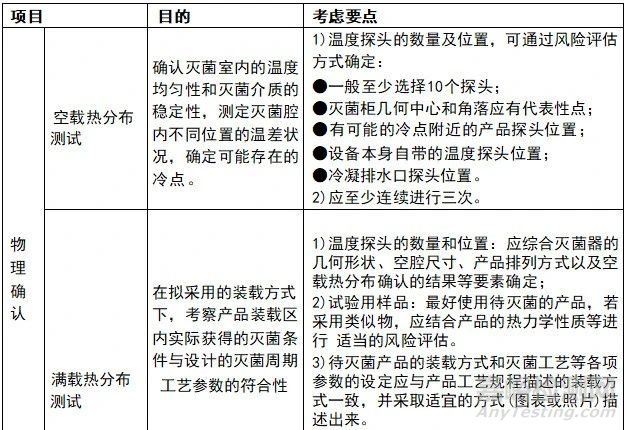
当要开展灭菌工艺验证时,需要确定对象(即确定的产品、确定的灭菌工艺 参数、确定的生产线的灭菌柜),成立验证小组,安排验证计划,撰写验证方案, 并对相关人员进行培训,并进行验证前准备及确认工作,准备及确认工作的关注点可见下图:

3、风险评估
灭菌验证的风险评估是确保注射剂在生产过程中达到无菌要求的重要环节。 在进行灭菌验证时,需要综合考虑多种因素,进行风险识别,制定风险评估原则, 进行风险评价,采取相应的风险控制措施,以确保灭菌过程的安全性和有效性。
需要综合考虑的因素有:1)选择合适的灭菌方法;2)验证方案设计是否合 理;3)在灭菌过程中,对关键参数的监控和管理是否到位;4)是否预估了潜在 风险(如验证结果不合格等)并准备了相应的管理措施。
总之,灭菌工艺验证的风险评估是一个系统的全面的过程,根据实际情况考 虑和分析,并进行相应的管理及措施,以确保最终的灭菌效果能够满足无菌保证 水平的要求。
4、灭菌工艺验证过程
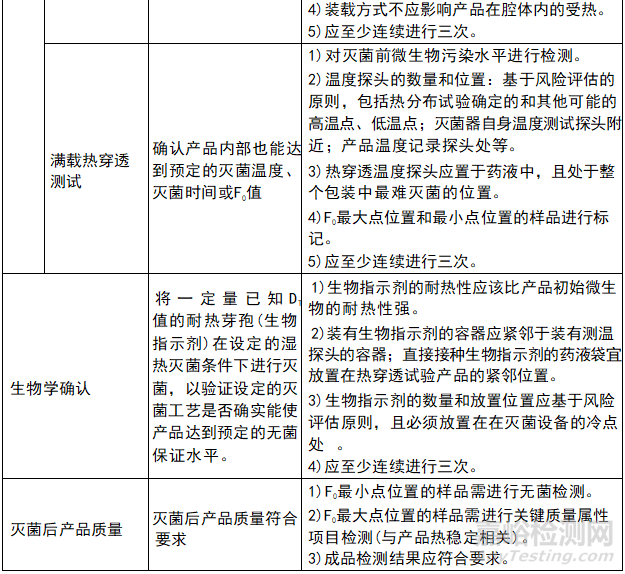
灭菌工艺验证包括物理确认和生物学确认两个部分。物理确认主要通过空载热分布试验、满载热分布试验、满载热穿透试验等方法来评估灭菌设备的性能和灭菌工艺的合理性;生物学确认则通过微生物挑战试验来确认灭菌工艺的有效性。
在测试结束之后,收集并分析处理测试数据:
1)在物理确认试验中,应确认关键和重要的运行参数并有相应的文件和记 录。需要关注的主要参数可能包括:
● 保温阶段每个探头所测得温度的变化范围
●保温阶段不同探头之间测得的温度差值
●保温阶段探头测得的温度与设定温度之间的差值
●升温阶段探头测得达到设定温度的最短及最长时间
● F0的最大值及最小值、灭菌结束时的最低F0值
●保温阶段腔室的最低和最高温度
●热穿透温度探头之间的最大温差或F0的变化范围
● 最长平衡时间
●正常运行的探头数
2)在生物学确认中,需要关注的主要内容可能包括:
●生物指示剂的基本信息:菌种名称,DT值,孢子量,有效期等
●灭菌后生物指示剂的培养结果
3)灭菌后产品质量检测结果汇总。
5、灭菌工艺验证结束
在灭菌工艺验证结束后,应对试验过程和结果进行分析,对关键数据进行汇 总,汇总并完善各种文件和记录,撰写验证报告,报告应包括验证方案、试验过 程、结果分析和最终结论。

来源:注册圈


