FDA的医疗器械开发工具(MDDT)计划旨在通过提供一种更高效、更可预测的方法来收集必要的信息,以支持监管提交和相关决策,从而促进医疗器械的开发和及时评估,并促进创新。
医疗器械赞助商可以选择在医疗器械的开发和评估中使用这些MDDT工具。这些工具包括:生物标记测试、临床医生报告的结果测量、患者报告的结果测量等工具,或者动物或计算模型等非临床评估模型,以及传感器或可穿戴设备等数字健康技术,使用它们有助于FDA了解医疗设备在安全性、有效性和其他性能方面的工作原理。
MDDT计划是自愿参加的,参加MDDT计划将有助于提高器械开发和监管审查的可预测性和效率。在决定是否对工具进行认证时,FDA会评估该工具和可用的支持证据,以确定其是否可用于在特定的使用环境下产生科学上合理的测量结果。医疗器械赞助商可以使用合格的工具,并确保它们将被FDA接受,而无需在相同的使用环境下再次确认工具的适用性和实用性。
为什么FDA制定MDDT认证计划?
在制定MDDT认证计划之前,FDA对每个医疗器械申请的工具进行了逐案评估。
FDA创建自愿MDDT计划的目的是:
• 通过关注评估新技术所需的科学来推进创新。
• 提高医疗器械申办者的可预测性,明确FDA接受MDDT的评估,以证明医疗器械在合格的使用范围内使用时的安全性、有效性或性能。
• 通过促进在多个医疗器械提交和制造商之间使用经过验证和合格的工具,提高效率和透明度。
• 鼓励在开发工具和支持证据方面的合作,以集中资源并推动合格工具的使用和接受。
目前批准的合格的医疗器械开发工具(MDDTs)有哪些?
FDA已经批准了用于心血管、神经病学、眼科、整形外科、自动胰岛素给药和成像设备的MDDTs,以及用于植入式医疗器械和网络安全的横切工具。
近日新增了一个工具--Chemical RISk (CHRIS) Calculator。
Chemical RISk (CHRIS) Calculator的特点
• 是一种非临床评估模型(NAM),可被医疗器械公司和赞助研究人员用于进行筛选级别的风险评估,以帮助对含有颜色添加剂(CAs)的聚合医疗器械组件进行生物相容性评估。
• 计算聚合医疗器械组件中包含的CA的安全值保守余量,以帮助确定是否需要根据用户提供的输入对CA和/或相关杂质进一步评估一个或多个生物相容性端点。与其他MDDT一样,所有评估都依赖于在其使用环境中使用的工具。
• 可协助器械制造商提供即时反馈,说明器械中是否存在CA或与CA相关的其他添加剂和杂质,需要额外的论证和/或测试,以证明可接受的生物风险。
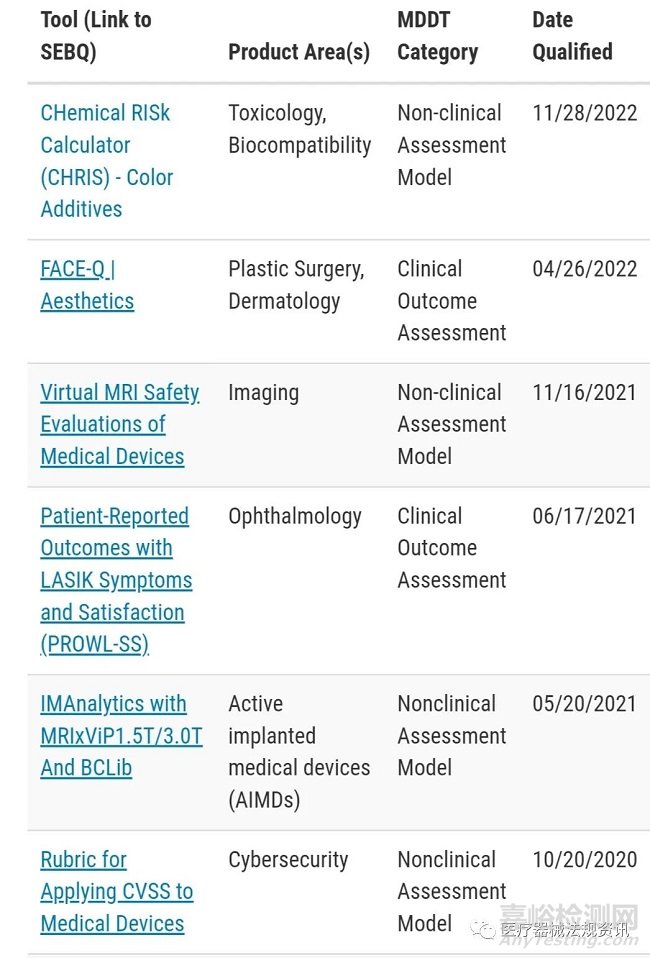
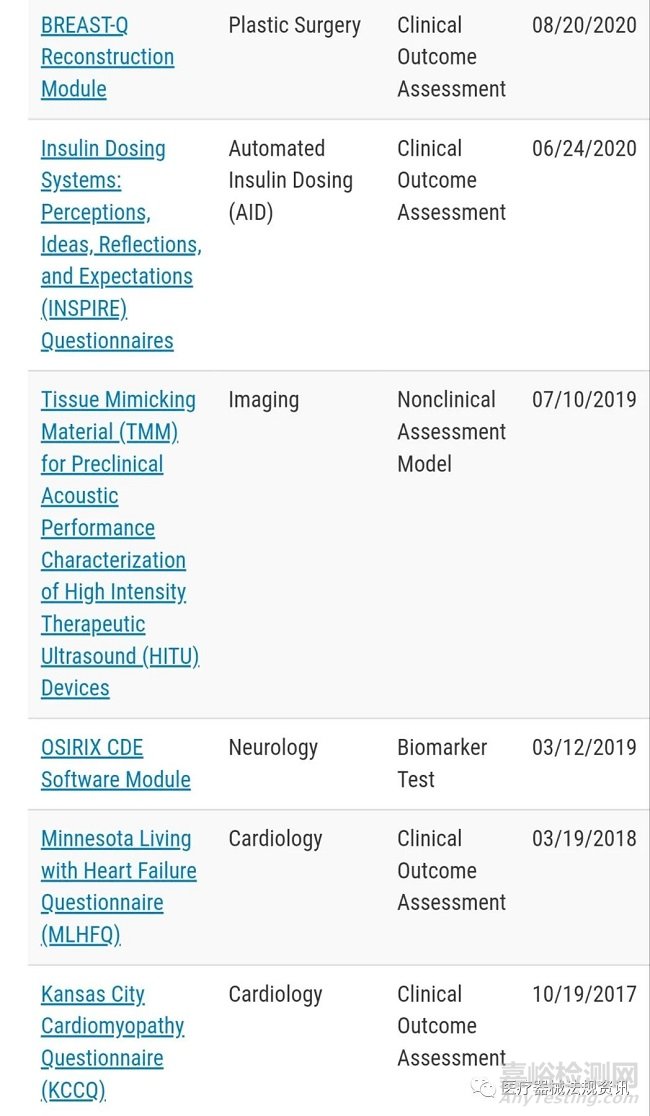
通过FDA认证的MDDTs见如下截图,每个批准的MDDT的证据和认证依据摘要(SEBQ)会公布在FDA官网。该总结包括:
• 工具的简要描述
• 限定的使用上下文
• 支持资格证明的证据概述
• 使用该工具的优点和缺点的简要评估
• 关于如何联系工具开发人员以访问工具的信息
医疗器械申办者提交依赖于合格MDDT的上市申请时,可在cover letter或3514表格(F或J部分)中包含MDDT提交编号。每个合格工具的MDDT提交号可以在SEBQ中找到。
MDDT类别有哪些?
FDA将MDDTs分为三类,主要通过工具测量相关参数的方式来区分:
1、临床结果评估(COA)可以通过临床医生、患者、非临床医生观察者报告或者通过基于性能的评估来进行。它可用于告知患者资格或临床研究终点。有关COAs的详细信息,请参见医疗器械决策中的临床结果评估(COAs)。
2、生物标记测试(BT)是一种用于检测或测量生物标记的测试或仪器。生物标记测试可用于评估风险,或识别安全性问题,或预测患者的治疗结果。
3、非临床评估模型(NAM)是一种测量或预测器械功能或体内器械性能的非临床测试模型或方法。它可以是计算机模型或动物模型,用于:
• 测量或预测感兴趣的参数
• 减少或取代动物试验
• 减少测试持续时间或样本量。
关于MDDT类别的更多信息,请见最终指南Qualification of Medical Device Development Tools。






