今日头条
和黄VEGFR抑制剂向FDA滚动递交NDA。和黄医药VEGFR抑制剂呋喹替尼向FDA滚动提交新药上市申请,用于治疗难治性转移性结直肠癌。在国际III期临床FRESCO-2中,与安慰剂相比,呋喹替尼显著延长患者的总生存期(中位OS:7.4个月vs4.8个月)和无进展生存期(中位PFS:3.7个月vs1.8个月)。和黄医药也计划尽快向在欧洲EMA和日本PMDA提交该新药的上市申请。
国内药讯
1.复星新冠mRNA疫苗获批香港上市。复星医药从BioNTech公司引进的新冠mRNA疫苗复必泰(BNT162b2)、复必泰二价疫苗获香港药监部门注册批准,其中,复必泰BNT162b2获批用于12岁及以上人群的基础免疫接种,复必泰二价疫苗获批用于12岁及以上人群的加强接种。此前,这两款疫苗均已获紧急授权用于香港政府接种计划。2021年财报显示,复星复必泰在港澳台的销售量达到2206万剂,销售规模超10亿元。
2.君实新冠口服药启动病毒反弹III期研究。君实旗下君拓生物与旺山旺水生物合作开发的口服核苷类抗新冠药物JT001(VV116)登记启动一项III期临床,旨在对比轻中度新冠患者接受VV116或辉瑞Paxlovid(奈玛特韦片/利托那韦片)治疗后病毒反弹的发生率。该项试验将在上海交通大学医学院附属瑞金医院和仁济医院 、上海市浦东医院开展。今年5月,VV116对比Paxlovid早期治疗轻中度新冠患者已达III期研究主要终点。
3.祐森健恒TYK2别构抑制剂上Ⅰ期临床。祐森健恒TYK2别构抑制剂UA021在澳大利亚开展的Ⅰ期临床首例健康受试者给药。UA021通过分子变构机制作用于TYK2激酶的JH2区域,且对JAK家族的其他成员有高度的选择性,有望降低不良反应。该新药拟开发用于治疗银屑病、炎症性肠病(IBD)等自身免疫性疾病。临床前研究表明,UA021较同类药物具有更好的药代动力学性质,且具有良好的安全性。
4.荣昌Claudin 18.2靶向ADC早期临床积极。荣昌生物靶向Claudin18.2的抗体偶联药物(ADC)注射用RC118在澳洲及中国开展的I期临床结果积极。初步数据显示,RC118在中国人及澳洲人中安全性和耐受性良好,在整个爬坡过程中,均未观察到剂量限制性毒性(DLT)事件。在美国,FDA已授予该新药两项孤儿药资格,适应症分别为胃癌(包括胃食管交界癌)和胰腺癌。全球范围内尚无Claudin18.2靶点药物获批上市。
5.纽福斯眼科基因疗法在美获批临床。纽福斯生物眼科基因治疗药物NFS-02(rAAV2-ND1)获FDA新药临床许可,用于治疗ND1突变引起的Leber遗传性视神经病变。NFS-02以重组腺相关病毒血清型2(rAAV2)为载体,通过单次玻璃体内注射,将正确的基因递送至患者受损的视神经节细胞,修复线粒体生物呼吸链,使视神经节细胞恢复活力与视功能。此前,FDA已授予NFS-02孤儿药资格。
6.奥赛康PD-1/IL-15双功能融合蛋白获批临床。奥赛康子公司AskGene申报的注射用ASKG915的新药临床试验申请获FDA批准。ASKG915是一款PD-1/IL-15双功能融合蛋白,可通过PD-1抗体实现肿瘤靶向性,并在肿瘤部位被局部激活。该新药拟开发用于晚期实体瘤的治疗。临床前数据显示,ASKG915具有良好的抗肿瘤活性,疗效显著优于PD-1单药疗法,同时安全性良好,治疗窗显著优于传统细胞因子类药物。
国际药讯
1.全球首个现货型T细胞疗法获欧盟批准。欧盟委员会(EC)批准Atara Biotherapeutics与Pierre Fabre联合开发的即用型同种异体T细胞免疫疗法Ebvallo(tabelecleucel)上市,用于单药治疗复发或难治性EB病毒(EBV)相关的移植后淋巴增殖性疾病(EBV+PTLD)经治患者(>2岁)。Ebvallo也是全球首款获批的现货型T细胞疗法。在关键III期ALLELE研究中,该药的总体缓解率达到50%(95% CI:33.4,66.6)。
2.利那洛肽治疗儿童便秘在美报sNDA。艾伯维与Ironwood公司开发的鸟苷酸环化酶-C(GC-C)激动剂利那洛肽已向FDA递交sNDA申请,用于治疗6-17岁儿童和青少年功能性便秘(FC)。在III期临床中,利那洛肽可显著改善患者的每周自发排便频率(SBMs频率/周),同时也改善了粪便硬度,安全性也与既往在儿童FC和肠易激综合征患者中的研究一致。如果获批,该新药将成为首款治疗儿童FC的处方药。
3.FIC口服NASH新药Ⅲ期临床成功。Madrigal公司潜在“first-in-class”口服甲状腺激素受体(THR)-β激动剂resmetirom治疗非酒精性脂肪性肝炎(NASH)的Ⅲ期试验达到共同主要终点。与安慰剂相较,resmetirom(80mg和100mg)治疗组达到NASH症状缓解与≥2分以上非酒精性脂肪性肝病活动评分(NAS)下降且没有出现纤维化恶化情形的患者比例更高(26%和30%,vs10%);肝脏纤维化至少有一个阶段的改善、且没有出现NAS恶化的患者比例也显著更高(24%和26%,vs14%)。预计明年上半年递交新药申请。
4.辉瑞PROTAC疗法启动乳癌Ⅲ期临床。辉瑞与Arvinas公司开发的靶向ER的PROTAC蛋白降解疗法ARV-471在Clinicaltrials.gov网站上登记首项Ⅲ期临床,计划入组561例晚期复发性乳腺癌患者,评估与氟维司群对比的治疗效果。在Ⅱ期试验中,ARV-471在接受前期中位4线疗法的患者中的CBR(完全、部分缓解,或疾病稳定≥24周)为38%,在ESR1突变患者中CBR达51.2%。
5.武田非病毒基因疗法临床前数据积极。武田与Poseida公司合作开发的基因疗法P-FVIII-101在ASH年会上公布临床前研究成果。P-FVIII-101是采用Poseida专有Super piggyback(SPB)DNA修饰系统和纳米颗粒递送技术,能够利用转座子(transposon)将目的基因永久性地导入细胞,具有功能性治愈血友病A的潜力。临床前结果显示,P-FVIII-101在单次给药后就能使小鼠内人类FVIII(hFVIII)活性达到并维持正常水平,并在单次和重复给药后均能提供具有治疗活性的FVIII。
6.阿斯利康PD-L1肺癌III期研究失败。阿斯利康PD-L1单抗Imfinzi(度伐利尤单抗)一线治疗IV期转移性非小细胞肺癌(NSCLC)的III期PEARL研究未达到主要终点。在PD-L1(TC≥25%)高表达亚组和早期死亡风险低亚组中,与铂类化疗相比,Imfinzi单药组均未达到统计学意义上的总生存期(OS)改善。但在PD-L1表达>50%亚组中,Imfinzi组患者的OS有所改善。Imfinzi的安全性与既往研究一致,没有发现新的安全信号。
医药热点
1.两位顶尖生物医药学者全职归国。浙江良渚实验室(系统医学与精准诊治浙江省实验室)日前连发两文披露,两位世界知名学者徐浩新教授、陈家明教授辞去美国顶级大学教职,全职回国加盟良渚实验室。徐教授长期从事神经生物学、细胞生物学、分子生物学等领域的教学和研究,是TRP通道及胞内离子通道研究专家,是溶酶体电生理记录的开创者,共鉴定了12种未知离子通道蛋白。陈教授专注于免疫学、细胞生物学等领域,是坏死性凋亡(Necroptosis)研究领域的专家,是受体相互作用蛋白激酶RIPK3的发现者,研究鉴定了RIPK3和相关的RIPK1在控制炎症疾病中的重要作用。
2.医疗机构手术分级管理办法出台。12月19日,国家卫健委发布《医疗机构手术分级管理办法》,要求医疗机构按照院、科两级负责制,根据自身功能定位、医疗服务能力水平和诊疗科目制定手术分级管理目录,进行手术分级管理。《管理办法》建立健全了从手术分级目录制定、医务人员授权、患者术后管理到医疗机构内部督查等手术分级管理全流程的制度设计,为医疗机构加强手术分级管理、提升手术质量、保障手术安全提供了依据。
3.上海门急诊就医无需查验核酸阴性证明。根据上海市当前疫情形势,为方便市民看病就医,上海市进一步优化门急诊就医流程,自20日起上海全市各医疗机构对门急诊患者不再查验核酸阴性证明。上海市卫健委要求各医疗机构严格落实首诊负责制和急危重症抢救制度,严禁以任何理由推诿或延误救治。
评审动态
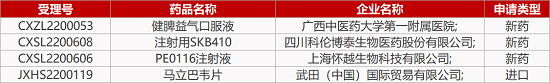
1. CDE新药受理情况(12月20日)
2. FDA新药获批情况(北美12月16日)