近日,礼来公司(Eli Lilly)宣布,其开发的用于治疗成人重度斑秃的口服JAK抑制剂巴瑞替尼(商品名:艾乐明)证实获得中国国家药品监督管理局(NMPA)批准。据悉,该药是国内首个、且唯一用于系统性治疗重度斑秃的创新靶向药物。
礼来表示,作为首款用于系统性治疗成人重度斑秃的靶向药物,此次艾乐明新适应症获批,填补了中国重度斑秃患者迫在眉睫的疾病治疗需求,也为医生带来了新的临床药物选择。
巴瑞替尼是一种免疫系统用药,由礼来和Incyte合作开发,2018年和2019年,该药分别在美国和中国获批,用于治疗一种或多种改善病情抗风湿药疗效不佳或不耐受的中重度活动性类风湿关节炎(RA)成年患者。目前,该药已进入国家医保目录。
巴瑞替尼自上市后,一直有着不错的市场表现,数据显示,巴瑞替尼2021年全球销售额为11.15亿美元,同比增长74.5%,2022年第一季度为2.556 亿美元,同比增长32%。
另外,米内网数据显示,巴瑞替尼在国内样本医院终端的销售额也大幅增长,2020年销售额为74万元,2021年增长到2268万元。
斑秃(AlopeciaAreata,AA)是一种常见的炎症性非瘢痕性脱发,临床表现为头皮突然发生的边界清晰的圆形斑状脱发,轻症患者大部分可自愈,约半数患者反复发作,病情严重者可进展至完全脱发或泛发性脱发。国外研究表明人群终生患病率约2%。其中约5%的斑秃患者会进一步发展为完全脱发或泛发性脱发。
相关流行病学研究表明我国斑秃患病率为0.27%,患病率的年复合增长率为0.46%,近20年我国斑秃患病人群规模趋于稳定:每年近400万人受其困扰。斑秃对外在形象、社会交往以及精神压力等方面造成的影响较大,包括睡眠和生活质量明显较差、广泛性焦虑症和抑郁情绪严重等。
斑秃的既往治疗基本上为口服和外用激素,最常见的即为米诺地尔。巴瑞替尼获批基于BRAVE-AA系列的两项研究(BRAVE-AA1和BRAVE-AA2)。该研究于2022年5月发表在《新英格兰医学杂志》上。
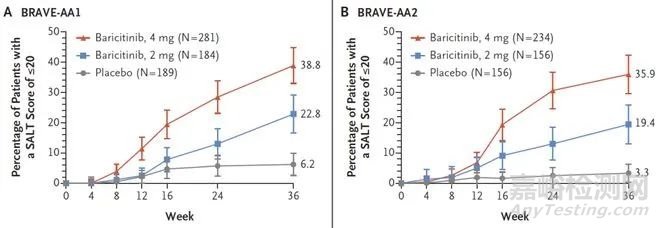
BRAVE-AA1和BRAVE-AA2为两项随机、安慰剂对照Ⅲ期研究。涉及严重斑秃的成年患者,其严重程度为脱发评分工具(SALT)评分为50或更高。该评分范围为0-100,0分为无头皮脱发,100分为头皮完全脱发。
两个试验分别招募654名、546名患者,其中亚洲患者的占比分别约为40%、30%。患者均以3:2:2的比例被随机分配接受每天一次的4mg巴瑞替尼、2mg巴瑞替尼或安慰剂治疗。试验的主要终点为第36周时,SALT评分为20分或更低。次要终点包括SALT分数相对于基线的百分比变化、SALT分数达到50的参与者比例等。
结果显示,BRAVE-AA1研究中,接受4mg、2mg巴瑞替尼和安慰剂治疗的患者中,SALT评分达到20分及以下的比例分别为38.8%、22.8%和6.2%。4mg巴瑞替尼和安慰剂治疗、2mg巴瑞替尼和安慰剂治疗之间的差异分别为32.6%、16.6%(P均<0.001)。
BRAVE-AA2研究中,接受4mg、2mg巴瑞替尼和安慰剂治疗的患者中,SALT评分达到20分及以下的比例分别为35.9%、19.4%和3.3%。4mg巴瑞替尼和安慰剂治疗、2mg巴瑞替尼和安慰剂治疗之间的差异分别为32.6%、16.1%(P均<0.001)。
在次要终点方面,4mg巴瑞替尼而非2mg巴瑞替尼要优于安慰剂治疗的效果。在安全性方面,低于2.6%的患者因不良事件而停止治疗,大多数治疗相关不良事件为轻中度。相比于安慰剂组,痤疮、肌酸激酶水平升高、低密度和高密度脂蛋白胆固醇水平升高在巴瑞克替尼组中更常见。此外,不建议巴瑞替尼与其他JAK抑制剂、生物免疫调节剂、环孢素或其他强效免疫抑制剂联合使用。
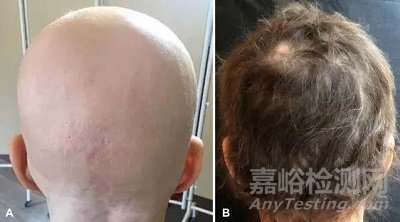
一名几乎完全脱发的女性接受每天4mg巴瑞替尼治疗,8个月后,其头发几乎完全恢复
除巴瑞替尼外,也有其他用于治疗AA的JAK抑制剂正在研发、申报阶段。
根据Insight数据库,辉瑞的利特昔替尼(Ritlecitinib)AA适应证在中、美、欧盟市场均处于上市申请阶段。据了解,该药是一款JAK3/TEC抑制剂,FDA和欧洲药品管理局(EMA)分别预计将在2023年第二季度、第四季度做出决定。2022年11月,国家药监局药品审评中心(CDE)官网显示,该药在国内的上市申请拟纳入优先审评,用于适合接受系统性治疗的12岁及以上青少年和成人斑秃患者,包括全秃和普秃。
此外,恒瑞医药的艾玛昔替尼(Ivarmacitinib)AA适应证也处于临床Ⅲ期阶段。
“出海”再下一城!这款重磅国产单抗品种杀疯了
3月28日,君实生物宣布,已与康哲药业东南亚业务(康联达)公司Rxilient Biotech Pte. Ltd.(康联达生技)及 Excellmab Pte. Ltd.(Excellmab)订立股东协议,君实生物将以非货币方式出资认购Excellmab 新发行的股份以获得其40%的股权。同时,Excellmab将获得在泰国、文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、越南合作开发和商业化特瑞普利单抗的独占许可及其他相关权利。这意味着,继北美、中东、北非后,特瑞普利单抗“出海”再下一城。截至目前,该重磅国产单抗品种的海外业务已累计拓展至超过30个国家。
根据本次许可协议,Excellmab将向君实生物支付合共最高不超过约452万美元的里程碑费款项,及产品于区域内净销售额一定比例的特许权使用费。同时,Excellmab也将获得许可协议约定的另外四款在研产品在区域内的商业化优先谈判权。
特瑞普利单抗是我中国头个批准上市的以PD-1为靶点的国产单抗药物,截至目前,特瑞普利单抗在中国大陆已有6项适应症获批,且有3项适应症纳入国家医保目录。在海外,特瑞普利单抗已获得FDA授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定,适应症涵盖黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌及小细胞肺癌等领域。
从特瑞普利单抗的“出海”经历来看,其实并非一帆风顺。早在2021年3月,君实生物便向FDA递交特瑞普利单抗上市申请,随后面临一项质控流程变更要求。2022年7月,FDA再次受理了特瑞普利单抗的上市申请,但在目标审评日期内(2022年12月23日),FDA没有进行现场核查。在审评延期3个月后,才有消息传出,FDA将在今年第二季度进行现场核查。截至今年2月27日,从君实生物披露的信息来看,特瑞普利单抗的BLA仍在审评中。不过,君实生物也在2月机构调研时表示,已做好充分准备工作以便随时接受FDA的现场核查,以期能够尽快推动特瑞普利单抗在美国实现商业化。
全面发力下,特瑞普利单抗给君实生物带来了亮眼的销售数据。2021年,随着特瑞普利单抗三线后治疗鼻咽癌和二线治疗尿路上皮癌适应症纳入医保,其销售收入也获得了较大增长。2022年,君实生物针对特瑞普利单抗完成了商业化团队的调整、营销地域团队的组建恢复工作,并补充了核心市场人员,2022年前三季度,该产品销售额达5.15亿,销售收入环比不断提升。同时,放眼整个2022年度,在疫情等因素影响下,特瑞普利单抗仍实现了销售收入的同比显著增长。
业内认为,未来随着特瑞普利单抗包括一线治疗食管鳞癌、一线治疗非小细胞肺癌等更多重磅适应症获批上市,该药的销售额有望进一步增长。君实生物方面日前也表示,公司在国内市场的销售情况已逐步进入正向循环,2023年起,特瑞普利单抗的销售有望持续改善。
而随着特瑞普利单抗加速出海的进程,未来特瑞普利单抗海外市场收入的潜力也值得期待,有望为公司带来新的业绩增长动力。