今日,美国FDA宣布,批准Seres Therapeutics公司口服微生物组疗法Vowst(SER-109)上市,用于在18岁以上成人中预防艰难梭菌感染(CDI)复发,这些患者曾经接受过抗生素治疗。新闻稿指出,这是FDA批准的首款口服粪便微生物组疗法,代表着微生物组疗法研发的重要里程碑。这款疗法在过去的十年里,经历了一波三折,如今终于硕果累累。它的获批历程也印证了该公司联合创始人,同时也是著名风投公司Flagship Pioneering的创始人兼首席执行官Noubar Afeyan博士的观点:“创新科学研究需要经历不断的挫败与经验积累,方能成就辉煌。”
人体的肠道中寄生着大量的微生物,这一微生物生态系统与人体产生紧密的相互作用,影响到生理学的多个方面。因此肠道菌群失调可能与多种疾病相关,其中包括炎症性肠病(IBD),癌症,自闭症,以及包括糖尿病,心血管疾病和肥胖症在内的代谢类疾病。有鉴于此,我们能否揭示微生物组的奥秘,并利用它们改善人类健康呢?秉持这一使命,Flagship Pioneering联手创建了Seres Therapeutics公司,于2012年崭露头角。它的目标是将对微生物组的洞见转化为全新的口服疗法类型,通过调节肠道微生物组治疗或预防多种疾病。
SER-109是该公司的研发重点之一,它由多种厚壁菌门菌种的纯化细菌孢子组成。这些微生物在调节艰难梭菌生命周期和CDI疾病发生方面具有重要作用。在1b期临床试验中,高达86.7%的患者达到试验主要终点。2015年,美国FDA授予这一疗法突破性疗法认定,意味着它与已有CDI疗法相比,具有为患者提供显著获益的潜力。
SER-109是一种口服、生物源性微生物组治疗药物,由多种厚壁菌门菌种的纯化细菌抱子组成,旨在减少艰难梭菌感染(CDI) 的复发,使患者通过打破CDI复发的恶性循环,恢复胃肠道微生物组多样性,达到临床缓解。
适应症:复发性艰难梭菌感染
商品名:Vowst
上市申请方:Seres Therapeutics
作用机制:胃肠道微生物组调节剂
药物类别:微生物药物
FDA首次批准日期:2023年4月26日
然而,2016年Seres宣布SER-109在2期临床试验的中期分析中未达到主要终点,在接受治疗8周之后,患者与对照组相比,CDI复发风险并未显著降低。这一结果为SER-109的开发前景蒙上了一层阴影。
对临床试验数据的进一步分析显示,对CDI患者的误诊和用药剂量不足可能是导致试验结果不如预期的原因。接下来是对疗法漫长的进一步优化和启动新一轮的临床试验。在这个过程中,Seres公司经历了公司重组,在2019年不得不裁员30%,将资源集中用于推动少数几个后期临床开发项目上。幸运的是,研究人员始终对SER-109的潜力充满信心,将其视为继续研发的重点项目之一。
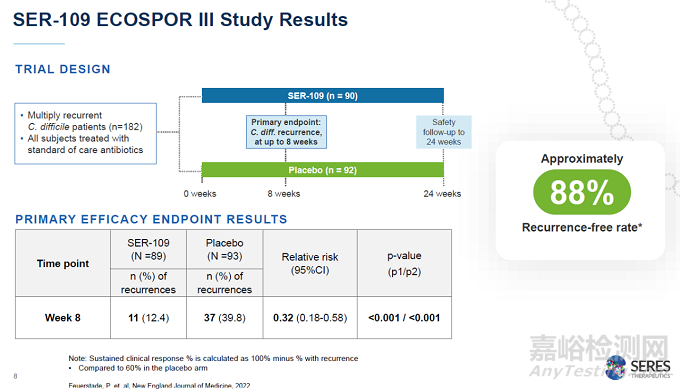
Seres公司的坚持在2020年终于收获回报,在关键性3期临床试验ECOSPOR III中,SER-109达到试验的主要终点,接受治疗8周后,SER-109组患者的复发率为12.4%,而安慰剂患者为39.8%。与安慰剂组相比,SER-109治疗组的疾病复发相对风险为0.32(95% CI,0.18,0.58)。这项临床试验的结果在著名医学期刊《新英格兰医学杂志》和《美国医学会杂志》上发表。去年10月,SER-109的生物制品许可申请获得美国FDA授予的优先审评资格。
▲SER-109的3期临床试验结果(图片来源:Seres公司官网)
Flagship Pioneering的创始人兼首席执行官Noubar Afeyan博士在今年年初发表的公开信中表示,创新技术平台的突破需要时间。核聚变研究在经过几十年的挫折之后,在去年年底获得突破。基于mRNA的新抗原癌症疫苗去年首次在随机对照临床试验中显著降低黑色素瘤复发或死亡风险,而Moderna的mRNA技术平台也经历了近10年的优化。Seres公司从创建至今,其口服肠道微生物组平台也经历了十余年的优化。如今,SER-109不但为解决未竟医疗需求提供了新选择,也有望开启微生物疗法的新时代。
诚然,将微生物疗法推广到治疗其它疾病仍然有许多路要走,前途也充满了各种挑战,近日,Seres公司的另一款微生物组疗法SER-287在治疗溃疡性结肠炎的临床试验中并未达到预期效果。然而,Noubar Afeyan博士在公开信中坚定地表示,面对挑战的坚韧不拔是创新者必须具备的品质。这些突破的实现提醒我们,将目光专注于远在地平线上的终极目标将带来无限的可能性!
康德为全球生物医药行业提供一体化、端到端的新药研发和生产服务,服务范围涵盖化学药研发和生产、生物学研究、临床前测试和临床试验研发、细胞及基因疗法研发、测试和生产等领域。如您有相关业务需求,欢迎点击下方图片填写具体信息。
参考资料:
[1] Seres one step closer to bringing first oral microbiome therapy to market as FDA mulls approval. Retrieved April 26, 2023, from https://www.fiercebiotech.com/biotech/seres-step-closer-bringing-first-microbiome-therapy-market-fda-mulls-approval
[2] New CEO axes 30% of Seres’ workforce to refocus on ‘high priority’ late-stage efforts. Retrieved April 26, 2023, from https://www.fiercebiotech.com/biotech/new-ceo-axes-30-seres-workforce-to-refocus-high-priority-late-stage-efforts
[3] Seres Therapeutics. Retrieved April 26, 2023, from https://www.flagshippioneering.com/companies/seres-therapeutics#:~:text=Founded%20by%20Flagship%20Pioneering%20in,bacterial%20diversity%20and%20function%20is
[4] SERES THERAPEUTICS RECEIVES FDA BREAKTHROUGH THERAPY DESIGNATION FOR ITS LEAD PRODUCT CANDIDATE, SER-109. Retrieved April 26, 2023, from https://ir.serestherapeutics.com/news-releases/news-release-details/seres-therapeutics-receives-fda-breakthrough-therapy-designation
[5] Seres’ microbiome drug fails to reduce C. difficile recurrence risk. Retrieved April 26, 2023, from https://www.healio.com/news/gastroenterology/20160801/seres-microbiome-drug-fails-to-reduce-c-difficile-recurrence-risk
[6] FDA Approves First Orally Administered Fecal Microbiota Product for the Prevention of Recurrence of Clostridioides difficile Infection. Retrieved April 26, 2023, from https://www.prnewswire.com/news-releases/fda-approves-first-orally-administered-fecal-microbiota-product-for-the-prevention-of-recurrence-of-clostridioides-difficile-infection-301808930.html