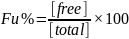一般认为药物与血浆蛋白结合成为复合体后不能跨膜转运,药物的分布,代谢,排泄以及与相应受体结合继而发生药理效应,都以游离形式进行,因此可认为游离药物才是血液乃至靶点的“活性药物”形式。这一学说(free drug hypothesis)已得到较多的药理实验和临床结果的支持。药物血浆蛋白结合率(Plasma Protein Binding,PPB)即血液中与蛋白结合的药物占总药量的百分数,可以反映药物与血浆蛋白结合的程度。药物进入循环系统后,因结构上的差异或多或少会与血液中的成分形成结合型(bound)药物,而未被结合(unbound)的部分则称为游离型药物(free drug)。药物的结合主要通过离子键,氢键,疏水性结合及范德华力结合,一般是可逆的,结合型药物分子变大不易透膜而“储存”于血液中,经血液运输通过游离药物分布到机体各组织部位。因病理等原因,药物与血浆蛋白结合的变化可能导致药物消除速率常数的改变,从而对体内血浆浓度产生暂时或持续的影响。因此对于治疗窗口窄,游离分数低,清除率高或分布容积小的药物,其血浆结合率在体内发生变化时可能具有潜在的临床意义[1]。
血浆蛋白结合率测定方法
目前常用于血浆蛋白结合率测定的方法主要包括平衡透析法(equilibrium dialysis, ED)、超滤法(ultrafiltration, UF)、超速离心法(ultracentrifugation, UC)和其他不常用的方法。结果通常表示为未结合分数(fu, fraction unbound)或蛋白结合率 (PB, % protein binding),公式如下:
1、平衡透析法(ED)
ED采用半透膜分割的两隔室装置进行测定,一侧加入含药的蛋白溶液,另一侧加入空白的缓冲液,此条件下仅游离药物可以自由穿过半渗透膜,孵育一段时间,两侧达到平衡后两侧的游离药物浓度相等,结合态的药物仍然停留于蛋白溶液侧,通过测定两侧的药物浓度即可算得PPB。下图1展示平衡透析法示意图。Theo de Boe and Henri Meijering在阐述了平衡透析法在蛋白结合率考察中的优缺点,见表1。
图1:平衡透析法的示意图[2]
|
优点
|
缺点
|
|
平衡透析耗材低的非特异性吸附特性,对Fu的测定影响小
|
耗时: 常规平衡透析3-48小时达到平衡;对于快速平衡透析2-6小时达到平衡
|
|
实验在二氧化碳培养箱中进行,可以控制实验温度和pH值
|
对于稳定性差的化合物不合适
|
|
快速平衡透析可以用96孔板,通量高
|
不适合在缓冲液中溶解性及其不好的化合物
|
|
快速平衡透析需要用的样品量少
|
传统透析需要样品量大
|
|
价格便宜,操作容易
|
|
表1:平衡透析方法的优缺点[2]
2、超滤法(Ultrafiltration,UF)
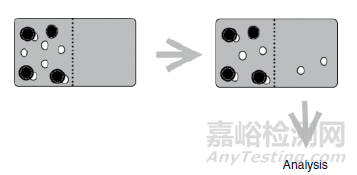
超滤法与平衡透析法类似,同样采用半透膜分隔的两隔室装置进行测定。含药蛋白溶液加入上层隔室,在外界压力或者离心条件快速的使游离药物运动至下方buffer侧,通过测定两侧化合物浓度计算蛋白结合率,图3为超滤法的示意图。该方法相对于ED优势在于其试验时间短,可显著减少酯酶代谢、蛋白稀释和蛋白渗漏造成的试验偏差。而该方法最大的劣势为药物非特异性结合效应较明显,尤其对于高脂溶性化合物,该类情况下可以采用测定buffer中结合率进行试验作为基础对照,考察无蛋白条件下化合物的结合情况,校正正式试验结果。Theo de Boe and Henri Meijering阐述了超滤法在蛋白结合率考察中的优缺点,见表2。
图1:超滤法的示意图[2]
|
优点
|
缺点
|
|
高准确度
|
使用外力(压力)。易受实验耗材的影响,例如:蛋白质泄漏。
|
|
高通量(96-孔板)
|
温度和pH值不容易控制
|
|
相对快速和容易实现
|
非特异性结合影响未结合部分
|
|
适用于不稳定化合物
|
使用96孔板时易受“边缘效应”影响
|
|
|
在超滤液中可能存在药物不溶性
|
|
|
不能用于高度疏水的化合物
|
表2:超滤法的优缺点[2]
3、超速离心法(Ultracentrifugation,UC)
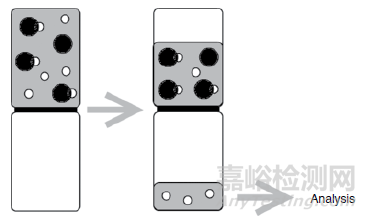
对于已含有药物的血浆基质,使用高速离心沉淀蛋白质和蛋白质结合的药,通过比较无蛋白上清液和完整的药物的浓度来计算游离分数,图4为超速离心法示意图。避免了膜相关问题(非特异性结合、跨膜渗漏等)是该方法的优势。但往往通量低,难以控制pH(可以显著影响蛋白质结合的条件),需要研究化合物在基质中较长时间稳定(典型的离心时间为2小时),上清可能不完全无蛋白质,导致观察到人为的高游离分数。Theo de Boe and Henri Meijering阐述了超速离心法在蛋白结合率考察中的优缺点,见表3。
图1:超速离心法的示意图[2]
|
优点
|
缺点
|
|
适用于高疏水性化合物
|
使用外力(压力)。
游离和结合药物的共沉降(MW >300 Da)
|
|
高准确性
|
温度可以控制,但pH值不容易控制
|
|
无膜的非特异性吸附现象
|
无高通量潜力
|
|
无体积移位和蛋白质渗漏现象
|
耗时且样品数量有限
|
|
|
不能用于不稳定的化合物
|
|
|
需要昂贵的设备和特殊的操作技能
|
|
|
上清中可能存在药物不溶性
|
|
|
需要的样品量体积大
|
表3:超速离心法的优缺点[2]
蛋白结合率技术的选择和分析方法的要求
血浆蛋白结合率实验中使用含有未标记化合物,可以采用LC-MS/MS来测定来自不同蛋白结合率实验的样品,计算出蛋白结合率。European Bioanalysis Forum (EBF) 将药物研发过程中蛋白结合率实验,分为Drug discovery阶段蛋白结合率研究,Drug development阶段体外蛋白结合率研究,Drug development阶段体内蛋白结合率研究。根据这三个阶段的蛋白结合率实验,EBF对一系列实验室进行了调研,并对调查结果进行了讨论,给出具操作性的建议。对于不同化合物,可以根据化合物的理化性质来挑选蛋白结合率测定方法[3]。
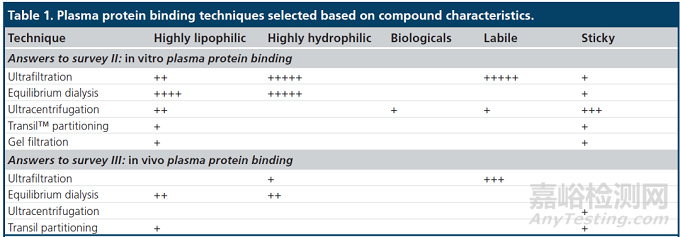
表1:根据化合物的性质选择血浆蛋白结合率技术。从Drug development阶段的体外血浆蛋白结合研究(上表)和体内血浆蛋白结合研究(下表)的调查中得到答案。符号的数量表明该技术是否被许多公司使用(符号数量较多)或仅被少数公司使用(符号数量较少)[3]。
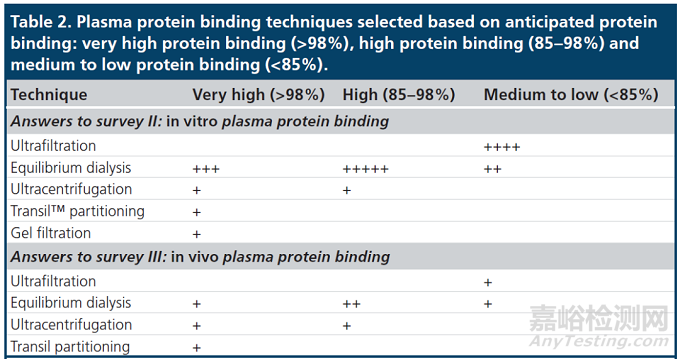
表2:根据预期蛋白结合率选择血浆蛋白结合率技术:可分为极高蛋白结合率(>98%)、高蛋白结合率(85–98%)和中低蛋白结合(<85%)。从Drug development阶段的体外血浆蛋白结合研究(上表)和体内血浆蛋白结合研究(下表)的调查中得到答案。符号的数量表明该技术是否被许多公司使用(符号数量较多)或仅被少数公司使用(符号数量较少)[3]。
对于Drug discovery和Drug development中,蛋白结合率实验中,生物分析方法验证的程度,业内没有详细的指导原则。不同的实验室经常使用从基本的筛选到完全验证的方法,来支持血浆蛋白结合率分析检测。EBF对不同实验室的情况进行了调研,并得出如下图结果。
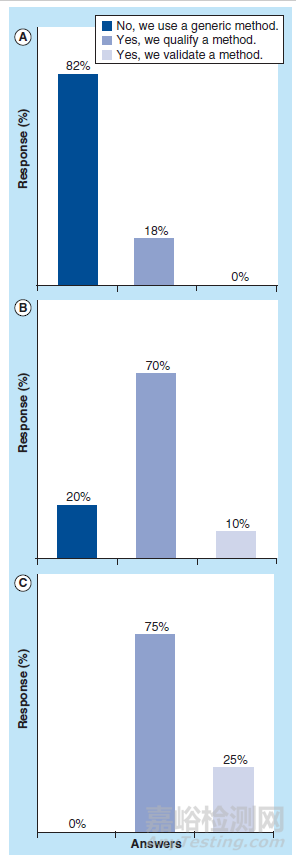
图5:在三个调查问题中,对于“是用确认或者验证的生物分析方法来分析蛋白结合率实验样品”得到的反馈。
(A):问题1:Drug discovery阶段蛋白结合率研究;
(B)问题2:Drug development阶段体外蛋白结合率研究;
(C)问题3:Drug development阶段体内蛋白结合率研究[3]
EBF建议采用分层方法设计蛋白结合率研究和检测蛋白结合率样品[3]。
1、在Drug discovery阶段
不需要实验计划
不需要做研究前的方法确证
不需要阳性对照
使用一个浓度(n=2)
使用通用分析方法(基于筛选或确认实验的要求)或者有限的预研究方法确认(标准曲线样品)
项目中的方法确认:有限的校准曲线样品,并提前定义扩大接受标准(25%的标准曲线准确度),QC样品可选
建议使用合适的内标
原始数据可用。如果要求,可提供简短的总结报告[3]。
2、在Drug development阶段(体内和体外蛋白结合率研究)
可以在实际的蛋白结合率研究之前进行初步实验,例如,记录非特异性结合或其他关键参数(基于先验知识或化合物类特征)。
可选阳性对照
使用至少三个药物浓度水平(每个水平至少三个重复)
使用已确认的方法或在项目中提前确认的方法:记录校准曲线、准确性、精密度、特异性、残留和稳定性
在研究中或者提前定义标准曲线和质控样品的接收标准(扩大到20%,对于定量下限是25%)
建议使用稳定性同位素内标
研究报告包括所有实验细节和结果[3]。
EBF对于蛋白结合率实验方法选择和要求的建议,为药物在临床阶段的蛋白结合率实验的开展给出了根本遵循和行动指南。
结语
在生物分析部,我们建立了临床血浆蛋白结合率的实验平台,已经开发,验证了多个蛋白结合率检测方法,可以为更多客户提供临床蛋白结合率检测服务。我们期待通过专业的业务能力,持续赋能客户的新药研发项目。
参考文献
[1]郭宾,李川.药物与血浆蛋白结合率的药理学基础及其研究进展.中国临床药理学与治疗学2005Mar;10(3): 241-253
[2]Theo de Boer and Henri Meijering, Equilibrium Dialysis, Ultracentrifugation, and Ultrafiltration in LC‐MS Bioanalysis
[3] Brigitte Buscher, Sirpa Laakso, Hermann Mascher, Klaus Pusecker, Mira Doig, Lieve Dillen,
Winfried Wagner-Redeker,Thomas Pfeifer, Pascal Delrat & Philip Timmerman. Bioanalysis
for plasma protein binding studies in drug discovery and drug development: views and recommendations of the European Bioanalysis Forum. Bioanalysis (2014) 6(5), 673–682.