您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-22 17:12
摘 要Abstract
随着现代生物医药新技术、新方法的飞速发展,增材制造(3D 打印)技术已应用于药物及医疗器械的开发和制造中,并凭借着高度的灵活性和广阔的应用前景受到制药企业的广泛关注。本研究系统梳理了3D 打印技术及其在制药领域的应用、相关政策以及3D 打印药物研发上市进展等,并结合访谈调研,从监管科学视角提出3D 打印药物研发上市的可能关注点,以期为3D 打印药物研发上市、惠及患者提前做好监管政策储备。
With the rapid development of new technologies and methods in modern biomedicine, 3D printing technology has been applied to the development and manufacturing of drugs and medical devices. Its high degree of flexibility and broad application prospects have attracted significant attention from pharmaceutical companies. This study systematically reviews 3D printing technology and its application in the pharmaceutical field, relevant policies, and the progress of 3D-printed drug development and marketing. Based on interviews and surveys, the paper identifies potential concerns for the R&D and marketing of 3D-printed drugs from a regulatory science perspective, so as to establish a policy framework that can support the development and marketing of these products and ultimately benefit patients.
关键词Key words
3D 打印;3D 打印药物;研发上市;监管科学;政策
3D printing; 3D-printed drugs; drug development and marketing; regulatory science; policy
近年来,增材制造技术(又称3D 打印技术)因其在降低复杂物件设计制造成本和提高效率方面的巨大优势,在机械制造、航空航天、建筑、医疗等领域应用广泛。同时,随着现代生物医药新技术、新方法的飞速发展,3D 打印技术已应用于药物及医疗器械的开发和制造中。与传统制造技术相比,3D 打印技术能够减少复杂的工艺流程,以较高的生产效率制造出具有特殊外形或复杂内部结构的药物,实现药物设计、制造的优化,在提高患者用药安全性、有效性和依从性等方面发挥着重要作用。
然而,3D 打印技术应用于药物研发也对传统监管模式和监管能力提出了新的要求。目前,全球仅有一款3D 打印药物,即于2015 年获得美国食品药品监督管理局(Food and Drug Administration,FDA) 批准上市的Spritam®,其他产品尚处于药物开发或临床试验阶段。我国本土制药企业三迭纪公司在3D打印药物领域积极布局,目前已有5 款产品进入临床试验阶段,在3D 打印药物产品管线数量上处于领先地位。需要注意的是,3D 打印药物研发上市仍存在一些问题亟待明晰,如3D 打印药物剂型和命名规则的确定,3D 打印技术对药物生产过程、质量控制的影响等。本研究系统梳理了3D打印技术及其在制药领域的应用、相关政策、3D 打印药物研发上市进展等,并结合访谈调研,从监管科学视角提出3D 打印药物研发上市的可能关注点,以期为3D打印药物研发上市、惠及患者提前做好监管政策储备。
1. 3D 打印技术及其在制药领域的应用优势
1.1 3D 打印技术概念、原理及分类
3D 打印又称增材制造,是利用计算机程序设计三维实体的数字模型,并用金属、高分子等材料通过分层打印、逐层叠加的方式直接制造出三维实体[1]。
3D 打印的工作原理是,首先通过计算机建模软件构建三维模型;其次,通过打印机配备的专业软件将模型文件处理为打印机可识别的描述方式,分为多层薄片,即切片;再次,打印机根据切片数据,通过特定的技术将材料逐层堆积形成物体;最后,对模型进行后期处理,包括固化、修整、打磨、上色等[2]。
根据美国材料与试验协会(ASTM)增材制造技术委员会(F42)的分类标准,3D 打印技术可以分为材料挤出成型技术、黏合剂喷射成型技术、粉末床熔融成型技术、光聚合技术、材料喷射成型技术、直接能量沉积技术和薄膜沉积技术7 大类[3]。其中,材料挤出成型技术、黏合剂喷射成型技术、粉末床熔融成型技术和光聚合技术4 类技术主要被应用于制药领域。制药领域典型3D 打印药物技术的原理和特点具体见表1。
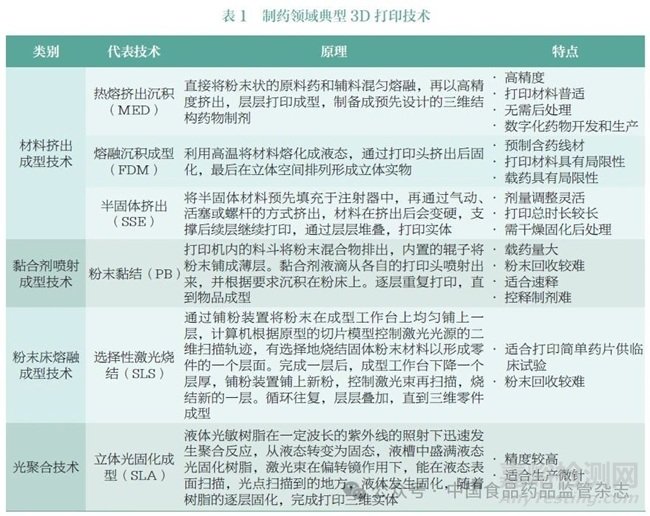
1.2 3D 打印技术在制药领域的应用优势
作为一种新兴技术,3D 打印在制药行业有着独特的优势[4-5]。
在规模化生产方面,其一,在3D 打印过程中,输入的物料可以被持续转化为药品,使得3D打印技术在药物连续生产方面具有较大优势。其二,规模化3D打印药物生产线的灵活程度较高,同一套生产线可以生产多种复杂制剂;同时,通过调整药物模型和相应的打印代码,相同的生产线可以生产不同释放机制的片剂、多层片和多腔室结构片等。其三,与传统的生产工艺相比,3D 打印药物生产具有明显的成本优势,如可减少溶剂使用量、减少在遵循药品生产质量管理规范(Good Manufacturing Practice ,GMP)要求的环境中进行生产和操作的空间和人员配置等。其四,3D 打印利用模型数据指导生产,可以采用数据采集与监视控制系统(supervisory control anddata acquisition,SCADA) 对生产线进行智能化管理,收集原辅料的称重、片重、药物活性成分(active pharmaceutical ingredient,API)含量等参数,动态监测药物的质量。
在个性化用药方面,通过3D打印技术能够精确设计药物的内部结构,从而实现特定的药物释放曲线。因此,可以根据患者的性别、年龄、体重、疾病严重程度等,应用3D 打印技术个性化制造药物。针对儿童和老人等特殊群体,由于患者对药物的需求(剂量、释放速率等)存在较大差异,可以通过3D 打印技术实现按需给药;针对慢性病患者,由于疾病进程不同、存在个体差异等,用药情况也会随之改变,应用3D 打印技术能够实现精准给药,降低不良反应并提高疗效。此外,3D 打印设备成本较低,生产效益高;小型和大型3D 打印设备的原理基本一致,能通过计算机软件控制相关技术参数,工艺重复性好,更易控制3D 打印药物的质量等。
2. 国内外3D 打印技术及相关政策进展
3D 打印技术属于新兴技术的范畴,目前各国和地区3D 打印技术相关政策正在探索和制定当中,笔者选取美国、欧盟与中国在医药领域的3D 打印技术相关政策进展进行介绍。美国、欧盟与中国均在3D 打印技术领域进行了战略性部署。其中,美国积极推动3D 打印技术的发展,其应用范围不仅广泛涵盖了医疗器械领域,还深入到了制药创新的前沿。欧盟围绕着新兴技术发布了相关政策。中国现阶段主要从国家战略层面和3D 打印医疗器械方面进行了相应布局。
2.1 美国
美国围绕新兴技术项目进行了积极部署,针对3D 打印医疗器械及药物发布了指南,同时鼓励3D打印技术在制药创新方面的应用。
在新兴技术层面,2014年, 美国FDA 药品审评与研究中心(Center for Drug Evaluation and Research,CDER) 药品质量办公室(Office of Pharmaceutical Quality,OPQ) 成立新兴技术项目(Emerging Technology Program,ETP), 制药企业在提交监管申请之前可以与新兴技术小组(Emerging Technology Team,ETT)成员会面,讨论有关创新技术开发和实施的潜在技术和监管问题。3D 打印技术属于新兴技术的范畴,ETT 参与了美国Aprecia 公司3D 打印药物Spritam®产品的审批。此外,2020 年4 月, 我国三迭纪公司的热熔挤出沉积(meltextrusion deposition,MED)技术入选ETP,其全自动集成过程分析技术(process analytical technology,PAT)及反馈控制的工艺创新获得了ETT 的认可。
在3D 打印医疗器械层面,2017 年12 月, 美国FDA 发布《增材制造医疗器械技术考量指南》(Technical Considerations for Additive Manufactured Medical Devices),从产品的设计制造和测试方面描述了3D 打印医疗器械涉及的风险点和要求[6]。2021年12 月,FDA 发布《护理点3D打印医疗器械:讨论文件》(3D Printing Medical Devices at the Point of Care: Discussion Paper),概述了使用3D 打印医疗器械的场景,并提出相关讨论问题,以征求行业和其他利益相关者意见[7]。
在3D 打印药物层面,2017年1 月, 美国FDA 的一项研究指出,3D 打印技术在复杂制剂、个性化产品以及按需生产产品方面具有竞争优势, 有利于提高药物的安全性、有效性和可及性, 并且在有效的风险管理措施下,应用3D 打印技术制造口服固体制剂是可行的[8]。2017 年9 月,FDA 发布《促进新兴技术用于制药创新和现代化行业指南》(Advancement of Emerging Technology Applications for Pharmaceutical Innovationand Modernization Guidance for Industry), 详细说明了制药企业如何参与ETP,以推动新兴技术( 如连续生产或3D 打印) 的应用[9]。2021 年2 月,美国国家科学、工程和医学研究院(National Academiesof Sciences, Engineering,and Medicine,NASEM) 发布《即将到来的药品制造创新:技术挑战、监管问题和建议》(Innovations in Pharmaceutical Manufacturing on the Horizon:Technical Challenges, RegulatoryIssues, and Recommendations)指出,应用3D 打印技术生产药品是全新的制造替代方案[10]。
2.2 欧盟
欧盟比较重视3D 打印技术的发展及战略规划,但目前涉及3D 打印医药的政策相对较少。
在3D 打印技术层面,1991~2013 年间,欧盟通过多个框架计划设立了3D 打印相关研究项目, 关注3D 打印材料的开发及技术应用。2015 年, 欧盟发布《3D 打印标准化路线图》(Additive Manufacturing: SASAM Standardisation Roadmap),明确了标准化对3D 打印技术及其应用发展的重要性,并指出需要制定的标准类型。2014~2020年间,欧盟设立“地平线2020”(Horizon 2020)计划,布局不同领域对3D 打印的专业化需求,重点研究多功能与多材料的3D打印,推动3D 打印行业快速发展。
在3D 打印医疗器械层面,2020 年4 月,欧盟发布《用于COVID-19 医疗环境的3D 打印和3D 打印产品的合格评定程序》(Conformity Assessment Procedures for 3D Printing and 3D Printed Products to be Used in a Medical Context for COVID-19),以问答的形式说明了3D 打印医疗器械的合格评定程序,以促进相关产品的研发上市[11]。
在新兴技术层面,2020 年3月,欧洲药品管理局(European Medicines Agency,EMA) 和欧洲各国药品监管机构负责人组织(Heads of Medicines Agencies,HMA) 共同创建欧洲创新网络(European Innovation Network,EU-IN),旨在推动创新医药企业之间信息和资源共享,为新兴技术和产品进入欧洲市场提供便利[12]。此外,EMA 组建创新科技基金(Innovation and Technology Fund,ITF),与申请人就新兴疗法和技术的科学、法律和监管问题进行沟通交流。2014~2016 年,EMA 与ITF 合作举办了92 次制药创新及科技基金简报会,以了解新兴技术的发展动态。
2.3 中国
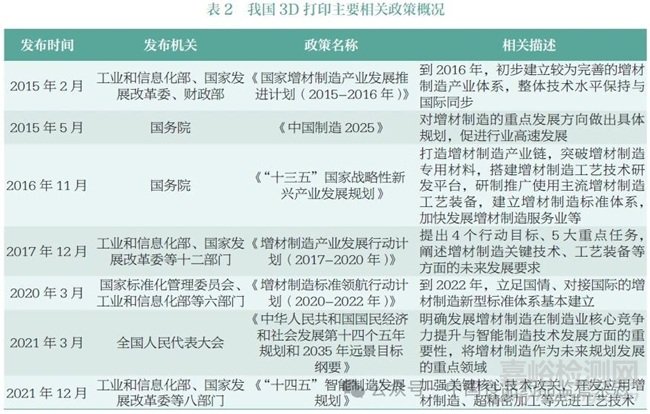
2015 年2 月,工业和信息化部、国家发展改革委、财政部联合发布《国家增材制造产业发展推进计划(2015-2016 年)》,将增材制造产业发展上升到国家战略层面。后续各部委围绕增材制造产业链、新型标准体系构建等发布了一系列政策,重点布局该领域的发展。我国3D 打印主要相关政策见表2。
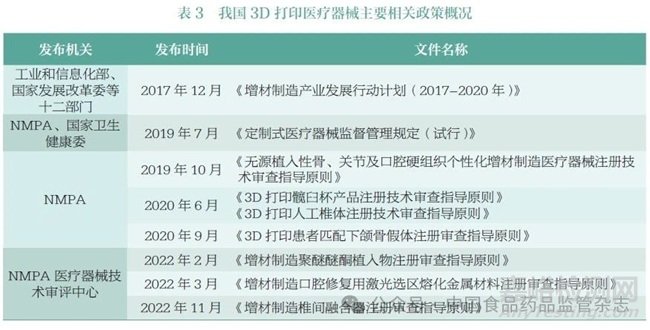
在3D 打印医疗器械方面,2017 年12 月,工业和信息化部、国家发展改革委等十二部门联合印发《增材制造产业发展行动计划(2017-2020 年)》, 提出要建立“3D 打印+ 医疗”的示范应用。2019 年6 月,3D 打印医疗器械专业委员会公布了《3D 打印医疗器械团体标准(第一册)》。2019 年7 月,国家药品监督管理局(National Medical Products Administration,NMPA) 和国家卫生健康委员会联合发布《定制式医疗器械监督管理规定(试行)》,旨在规范定制式医疗器械注册监督管理,保障其安全性、有效性,满足患者个性化需求。2019 年以来,NMPA 及医疗器械技术审评中心发布多项3D 打印医疗器械相关指导原则,指导申请人进行相关产品注册申报,以促进3D 打印医疗器械的研发上市。我国3D 打印医疗器械主要相关政策见表3。在3D 打印药物方面,我国尚未出台专门的政策文件。
3. 3D 打印药物研发上市进展
3.1 总体情况
目前,3D 打印药物公司和活跃研究机构主要分布在欧洲、美国和中国,研究阶段按照技术成熟度及应用方向可分为药物早期概念研究、个性化给药以及商业化开发[13]。全球范围内,3D 打印药物领域的大多数机构尚处于早期概念研究阶段。个性化给药方面,主要参与者包括英国阿斯利康、荷兰应用科学研究机构TNO 和3 家专业3D 打印药物公司FabRx、Multiply Labs 和DiHeSys。商业化开发方面,全球范围内将3D 打印技术应用于商业化开发阶段的仅有2 家公司,分别为美国Aprecia 公司和中国三迭纪公司;此外,美国默沙东和德国默克等跨国药企也在研发探索中[14]。产品方面,全球已上市3D 打印药物为美国Aprecia公司开发的左乙拉西坦口崩速释片( 商品名:Spritam®)。中国三迭纪公司有5 款产品已经获批新药临床试验(investigational new drug,IND) 申请。其中,T19、T20、T21、T22 已获得美国FDA 的IND 批准,T19、T20G、D23 已获得我国IND 批准。中国三迭纪公司3D 打印产品概况具体见表4。

3.2 首款3D 打印药物上市情况
2015 年,美国FDA 批准第一款3D 打印药物左乙拉西坦口崩速释片( 商品名:Spritam®)用于癫痫治疗。该剂型可快速崩解,易于吞咽,患者仅需饮用一小口液体即可于口腔中将药物快速分散。同时,该剂型呈白色、圆形、多孔状,有薄荷味,可掩盖左乙拉西坦的味道,有利于提高患者依从性,临床上尤其适用于在吞咽较大片剂或胶囊剂时存在困难的患者。
在Spritam® 审评过程中,FDA 主要关注临床试验、剂型命名和药学研究等方面的内容[15]。在临床试验方面, 该产品的获批主要得益于一项与参比制剂Keppra®(IR) 的生物利用度(bioavailability,BA)/ 生物等效性(bioequivalence,BE)桥接研究和一项药代动力学(pharmacokinetics,PK)研究。研究结果显示,二者PK 曲线具有可比性,证明二者生物等效。FDA 认为,Spritam® 的临床安全与有效性被视为与已获批的Keppra®(IR)相似,在相同适应症人群中使用Spritam® 不存在新的安全性问题及其他不明确的问题,获益- 风险评估为正向,同意批准其上市。
在剂型命名方面,由于该产品采用3D 打印技术,FDA 各级官员对其剂型命名存在争议。部分审评员认为,Spritam® 与普通片剂的使用方法存在较大差异(Spritam® 与液体一起服用时,不应立即完整吞服,而是当药片在口腔内完全崩解后才能吞咽),如果将其定义为片剂,则意味着Spritam® 可与传统左乙拉西坦片自由互换使用,患者可能会采用普通片剂给药方式服用Spritam® 而影响药物性能或引发安全风险。部分审评员提到,如果Spritam® 和Keppra®(IR)无法区分,那么在医院药物系统的处方、配药和给药阶段就很容易混淆。但经过FDA 内部多轮讨论及与申请人讨论,最终基于3D打印是一项新生产工艺,FDA 确认Spritam® 剂型为片剂,并于2016 年改名为口服分散片,与普通片剂在剂型命名上并未区分。
在药学研究方面,FDA 的审评工作主要集中于原料药、生物药剂学、硬度、孔隙率和崩解时限等方面。FDA 认为,原料药物理性质对3D 打印药物质量有关键影响,故申请人应提供该产品及其原料药的物理化学性质及3 批次每种规格的3 个月长期和加速稳定性数据。在质量控制项上,根据《美国药典》(USP)关于左乙拉西坦片的规定,该产品质量控制项包括鉴别项(红外鉴别)、含量、溶出度、有关物质。除此之外, 审评员还特别关注Spritam®的硬度、脆碎度和孔隙率等质量控制项,以及溶出度及崩解试验数据等。经审查,FDA最终同意申请人使用崩解试验代替溶出试验用于成品放行和稳定性试验。
4. 3D 打印药物研发上市关键问题剖析与思考
4.1 3D 打印药物临床试验的考量点
3D 打印技术在制药领域有较大的应用潜力。对于创新药,应用3D 打印技术可设计制剂结构以帮助药物释放,提高新药暴露量;对于改良型新药,3D 打印技术可通过精准的数字建模设计独特的制剂空间结构,从而实现药物的精准或快速释放。从现阶段研发进展看,3D 打印技术主要应用于多款改良型新药中,笔者重点围绕改良型新药临床试验可能涉及的问题展开分析。
在3D 打印药物的临床优势方面,3D 打印技术作为一种创新的先进制造技术,不仅能够简化工艺,提高药品的生产效率和成本效益,为复杂药品制剂的开发带来显著的技术与经济优势,还能实现药片尺寸的精确定制,提升用药便利性和个性化程度,确保患者获得实质性益处。目前,改良型新药的临床优势主要从有效性、安全性以及依从性3 方面认定。3D 打印技术作为先进制造技术,在简化工艺、提升用药便利性和可及性方面的优势应当予以鼓励和考量。
在3D 打印药物的临床试验层面,3D 打印药物本质在于剂型源于设计(formulation bydesign),其临床试验路径与常规药品存在相似性。目前,我国不同类型的改良型新药临床试验要求有所不同。例如,对于改善依从性的临床开发路径主要考量两个方面:①若改良后新药与原药品相比,PK 行为发生了变化,则需要首先通过PK 研究,探索合理的剂量与给药间隔,满足预设的临床用药要求,之后再开展随机对照临床试验验证改良型新药至少在保持不劣于被改原药品有效性和安全性的前提下,提高患者用药依从性。②对于避免特定患者用药困难等特殊制剂的化学药品改良型新药,如婴幼儿的特殊剂型等,临床获益明确,可在设计改良型新制剂前与NMPA药品审评中心沟通,根据剂型特征制定特定的临床研发要求。但笔者检索NMPA 及药品审评中心网站与医药魔方数据库发现,自2016 年3 月化学药品注册分类改革以来至2023 年6 月,在我国获批上市的2 类化学药品中,以改善依从性为目标的品种共14种。其中,有3 种开展了Ⅲ期关键临床试验;有10 种仅通过与被改良剂型开展BE 试验获批上市;有1 种基于系统综述获批上市,免于开展临床试验。因此,对于3D 打印药物,需要进一步结合其开发路径、原理明确临床试验相关要求。
4.2 3D 打印药物命名的考量点
3D 打印药物与传统药物的本质区别在于生产工艺不同,应当属于2.2 类的新处方工艺。在命名方面,根据2006 年原国家食品药品监督管理局发布的《中国药品通用名称命名原则》,从传统缓控释片改为3D 打印缓控释片,在名称上无法体现3D 打印的特殊工艺。
此外,为进一步规范化学药品通用名称命名,2020 年5 月,国家药典委员会组织草拟了《化学药品通用名称命名原则(征求意见稿)》,其中提出:缓释制剂由于制剂工艺不同,导致其组分释放行为不同而造成临床用药有差异的药品,按照不同缓释机理,采用通用名称加注罗马数字Ⅰ、Ⅱ、Ⅲ等后缀区分缓释制剂名称[16]。2022 年9 月,国家药典委员会再次就《化学药品通用名称命名指导原则(征求意见稿)》向社会公开征求意见,其中提出:部分品种由于某些原因可在名称中加罗马数字,除本文件涉及的情形外(涉及的均为复方制剂的情形),应谨慎采用在名称中加罗马数字的命名方式[17]。两版征求意见稿中,对不同缓释机理的缓释制剂命名是否可以加注罗马数字Ⅰ、Ⅱ、Ⅲ等后缀加以区分的表述存在一定差异。
对于首款3D 打印药物,美国FDA 最终确认其剂型为片剂。但FDA 也提及,如不区分命名可能会出现患者服药方式错误而影响药品性能或引发风险,且在药物系统的处方、配药和给药阶段容易混淆。因此,从鼓励新技术发展、确保临床用药安全的角度,可考虑对3D 打印药物加注罗马数字Ⅰ、Ⅱ、Ⅲ等,与普通缓控释药品进行区分。
4.3 3D 打印药物生产和质量控制的考量点
结合国内外3D 打印相关医疗器械技术指南、产品注册审评报告以及对3D 打印药物相关专家学者的访谈,笔者对3D 打印药物生产和质量控制提出以下考量点。
一是材料层面。由于3D 打印技术的特殊性,材料的分子链在受热和剪切条件下可能发生断裂、重新排列或交联等反应,从而改变材料的结构和性能,使得起始材料经历显著的物理和(或)化学变化。因此,对于3D 打印药物材料应重点关注以下几点:①明确高分子材料选择标准,如高分子材料需为药用辅料,溶解特性需与溶出需求匹配,高分子材料应可加工、可打印等。②评估高分子材料打印前后物理化学性质变化,应当结合材料属性和工艺流程,分别检测打印前、打印后材料和终产品的化学成分和组成、微观结构、力学性能等,明确各项性能指标的符合标准。③评估高分子材料与原料药之间的相互影响,应当研究高分子材料与原料药混合体系的化学相容性和物理性能变化,如玻璃化转变温度、熔融温度、原料药结晶度、分子量分布等。④控制工艺过程以实现高分子材料稳定性,如温控精度和速度、螺杆转速、物料在机筒中的停留时间、熔融压力等。
二是设备层面。3D 打印过程中相关设备可能会出现一些常见问题, 如喷嘴距离打印床过近、喷嘴堵塞、打印头偏离床面、挤压不足、过度挤压、重影或震纹等。对于3D 打印药物设备应重点关注以下几点:① 设备设计应符合相应的标准。参考标准具体包括:国际标准化组织(International Organization for Standardization,ISO) 标准、GMP 标准、美国机械工程师学会- 生物工艺设备(American Society of Mechanical Engineers-Bioprocessing Equipment,ASME-BPE) 标准等。②设备与工艺要求应相匹配。例如,在设计设备之前,需要明确产品进行3D 打印的整体工艺流程,详细了解各段工序的功能及具体要求,包括打印材料的特性,具体工艺参数范围,打印、运动、检测的精度要求,产品质量检测方法及标准等,根据各流程不同的动作和需求,完成相关设备的功能设计和选型。③设备的确认和验证。应当建立完善的设备安全确认、操作确认、性能确认等制度,确保符合要求的设备在合格的环境中被正确使用;定期验证设备的控制程序,阐述控制程序的验证方法,避免控制程序发生错误而引起不良后果;若设备的控制程序更新或升级,应当及时确认。
三是软件层面。3D 打印药物从数据获取、设计到生产制造,涉及不同的软件,每个软件均有相应的数据格式和参数,故软件之间的数据接收和转换的效率和质量会影响最终产品的性能。对于3D 打印药物软件应当重点关注以下几点:① 文件的转换和兼容。美国FDA 建议采用ISO/ASTM 52915《增材制造文件格式规范》(Specification for Additive Manufacturing File Format) 中推荐的AMF 格式,并建议进行过程确认。对于软件的任何变更,均应当有记录,且该变更应经过验证[18]。②软件验证。应当验证数据采集、处理、传输、性能预测等软件的兼容性、容错及可重复性等;验证影像扫描、数字模型设计、切片、路径规划的整个软件工作流程。③软件确认。应当定期确认关键软件(如支撑、切片软件)的有效性,并在更新升级时再次确认。
四是工艺层面。与传统制药工序相串联的设计不同,3D 打印连续化生产是“端到端”的全新工艺和数字化制药生产技术。对于3D 打印药物的工艺应重点关注以下几点:① 持续工艺验证。工艺验证应充分详尽,运用风险评估的方法确定关键工艺参数,制定详尽的验证计划和持续工艺控制监测计划,以确保稳定的生产操作和持续的药品质量。②监测相关变量,包括工艺过程中的工艺参数,输入物料、中间过程物料及输出物料的属性、温度等变量。例如,对于MED 技术,尤其需要关注温控精度和速度,如果冷却时温度不一样,则易成固态溶液,即得无定型固体分散体,同时温度变化会导致材料和制剂的老化,发生晶型的改变。③对监测数据进行分析。可采用的工艺过程监测数据分析模式包括基于控制限度的单变量分析、多变量分析或工艺模型、批间和批内趋势分析(如移动平均线和方差分析)。同时,对于3D打印工艺过程仍需要关注清洁验证,需要重点考虑最长生产周期、单次清洁时间、清洁有效期和滞脏时间。
五是质量标准层面。传统片剂的质量检查项目包括外观性状、片重、硬度和脆碎度、崩解度、溶出度或释放度、含量均匀度等。因不同3D 打印技术的成药形态不同,3D 打印药物质量标准具有一定的特殊性。例如,针对采用MED 技术生产的3D 打印药物,一般检查项目包括含量均匀度、溶出度、片重等,但不适用脆碎度、崩解时限等项目。考虑到3D打印药物质量标准的特殊性,可针对性地确定特定3D 打印药物的质量标准,明确是否包括特定质量控制项。
5. 结语
3D 打印工艺凭借高度的灵活性,可在药物开发中灵活设计药物内部结构、调控药物释放行为,实现药物的精准控释,具有比传统制药工艺更简易、更高效的优势,可为患者带来更多的临床获益。同时需要看到,3D 打印药物仍处于开发早期,其临床试验要求、命名规则、生产及质量控制标准等仍需要进一步探索研究,以期为3D 打印药物尽早上市、惠及患者奠定基础。
引用本文
谢金平,黄淼,朱梦雅,陈怡,邵蓉*.监管科学视角下增材制造(3D 打印)药物研发上市关键问题及监管政策研究[J].中国食品药品监管.2025.2(253):50-61.

来源:中国食品药品监管杂志


