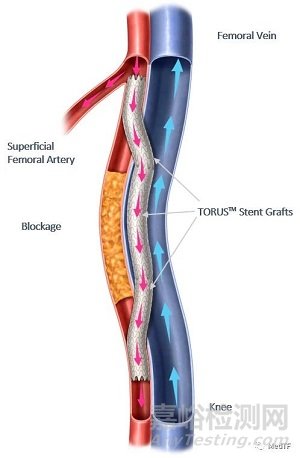
Endologix宣布FDA批准其产品DETOUR用于治疗复杂外周动脉疾病(PAD)。DETOUR上市为复杂PAD疾病带来了全新疗法,使医生能够通过使用穿过股静脉的支架来绕过股浅动脉的病变,以恢复腿部的血流。这种方法对长病变(长度为20厘米-46厘米)的患者、已经经历过血管内手术失败的患者或可能是开放式手术旁路的次优候选者的患者特别有效。
高管评价
“我们很高兴获得美国食品药品监督管理局对DETOUR的批准。PTAB(Percutaneous Transmural Arterial Bypass)疗法是复杂PAD患者向前迈出的重要一步,他们长期以来一直需要一种更有效、侵入性更小的SFA长病变治疗方案。我们很自豪能够开创这种新方法,并代表患者继续创新。我们期待着在未来几周内通过有针对性的市场发布在美国推出这种新疗法。”
----Matt Thompson Endologix CEO
DETOUR
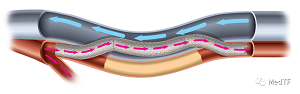
DETOUR是一种新颖的可经皮股动脉腘搭桥术。将专有的TORUS支架通过两个独立的吻合线以连续,重叠的方式从腘动脉到股静脉,再从股静脉到股浅动脉,形成一系列的环状支架。预期的结果是一个大的腔内移植旁路,可从股腘动脉向股浅动脉传递通畅血流。 DETOUR能提供长期的耐用性,同时最大程度地减少对身体的伤害,住院时间和康复时间。
DETOUR由PQ Snare、PQ Crossing Device和TORUS支架组成。
TORUS 支架是一种覆膜自膨胀支架由聚四氟乙烯 (ePTFE) 膜和镍钛合金制备。
PQ Snare 是一种由镍钛合金编织的双笼状支架。
PQ Crossing Device一种弹簧式导丝支撑和输送系统,用于建立通道。
DETOUR临床
Endologix公布DETOUR的IDE临床研究数据:
202名患者参加本项研究,所有患者都患有严重股腘动脉疾病。96%的患者有慢性全闭塞(CTO),平均病变长度为327.14 mm,CTO长度为217.31 mm,70.4%的患者有严重钙化。治疗结果如下:
12个月时一期通畅率为72.1%(Kaplan-Meier估计)
30天时主要不良事件发生率为7%
30天和12个月时深静脉血栓形成(DVT)的发生率分别为2.5%和4.1%
12个月内未发生肺栓塞
Endologix
Endologix是一家总部位于加利福尼亚州的全球性医疗器械公司,致力于通过为血管疾病的介入治疗提供创新疗法来改善患者的生活。Endologix的产品组合包括各种处于不同发展阶段的产品,旨在治疗目前临床未满足的相关血管疾病。这些产品用于治疗广泛的血管疾病,从腹主动脉瘤到下肢周围血管疾病。