今日头条
苏州天马创新PDC获批实体瘤临床。苏州天马医药旗下天吉生物研发的注射用BGC0222获国家药监局批准开展临床研究,拟开发用于结肠癌、胰腺癌、乳腺癌、小细胞肺癌、胃癌及脑胶质瘤等实体瘤的治疗。BGC0222是一款多肽偶联药物(PDC),属于一种新型的基于高分子载体的肿瘤靶向配体偶联药物。2022年2月,天吉生物已与博瑞生物达成BGC0222的技术转让协议。
国内药讯
1.AZ依库珠单抗获批重症肌无力NDA。阿斯利康“first-in-class”C5补体抑制剂依库珠单抗注射液(eculizumab)获国家药监局批准新适应症,用于治疗抗乙酰胆碱受体(AChR)抗体阳性的难治性全身型重症肌无力(gMG)成人患者。这是该新药在国内获批的第三项适应症。此前,国家药监局已批准该药用于治疗成人和儿童阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)。
2.康方PD-1/VEGF单抗启动头对头III期临床。康方生物开发的PD-1/VEGF双抗Ivonescimab(依沃西单抗)在clinicaltrials.gov网站登记启动一项III期研究(HARMONi-3),拟评估与PD-1抑制Keytruda对比,联合化疗一线治疗转移性鳞状非小细胞肺癌的有效性与安全性。去年年底,康方生物已在国内启动依沃西单抗头对头K药一线治疗NSCLC的III期研究(CTR20222137),并计划在本月启动依沃西单抗头对头替雷利珠单抗一线治疗鳞状NSCLC的III期研究。
3.石药HER2靶向ADC启动头对头III期临床。石药集团中奇制药重组人源化抗HER2单抗-MMAE偶联药物DP303c(SYA1501)登记启动一项III期研究,拟评估与曲妥珠单抗对比,联合长春瑞滨/卡培他滨三线及以上治疗HER2阳性晚期乳腺癌的有效性与安全性。该项试验由复旦大学附属肿瘤医院医学博士胡夕春担任主要研究者。除乳腺癌外,DP303c用于治疗胃癌、卵巢癌的相关研究也已进入II期临床阶段。
4.苏州鑫康合B7-H4单抗国内获批临床。鑫康合生物靶向B7-H4的潜在“first-in-class”抗体药物XKH002获国家药监局临床试验默示许可,拟开发用于治疗晚期实体瘤。XKH002能够特异性结合B7-H4并有效阻断B7-H4介导的对T细胞增殖和免疫反应的抑制作用,有助于恢复和增强机体抗肿瘤免疫应答,特别是对PD-1/PD-L1抗体药物治疗不反应、反应不灵敏或者产生耐药的患者具有治疗潜力。在美国,该新药已于今年2月获得FDA临床许可。
5.迈威IL-11单抗美国获批临床。迈威生物宣布其靶向IL-11人源化单抗9MW3811的临床试验申请已获得FDA批准。9MW3811通过高效阻断IL-11下游信号通路的活化,抑制IL-11诱导的病理生理功能,从而达到对纤维化和肿瘤的治疗效果。该新药目前正在澳大利亚开展Ⅰ期临床,阶段性数据显示其安全性良好;今年5月,该新药也获得CDE临床许可,将针对晚期恶性肿瘤和特发性肺纤维化开展临床研究。
6.成都西岭源HER2靶向ADC报IND。西岭源药业HER2靶向ADC新药注射用SMP-656的临床试验申请获CDE受理。这是西岭源药业开发的首个ADC候选药物,采用已上市药物(艾立布林)为Payload,并利用其专有DAR4偶联技术和SuperHydra亲水性linker结合,具有更有效、更安全的开发潜力。去年年底,西岭源药业已完成近亿元Pre-B轮融资,以支持SMP-656的IND申报以及Ⅰ期临床开发。
7.中生制药引进鸿运华宁减肥药。中国生物制药宣布已与鸿运华宁达成合作协议,获得后者临床期GIPR拮抗/GLP-1R激动剂候选减肥药物GMA106在大中华区的独家开发和商业化权益。澳洲I期临床数据显示,GMA106分子内的抗体半衰期长(约53天),停止用药后(3-5个月) 明显防止受试者减重后反弹。根据协议,鸿运华宁将获得最高5700万美元的首付款与里程碑付款等。
国际药讯
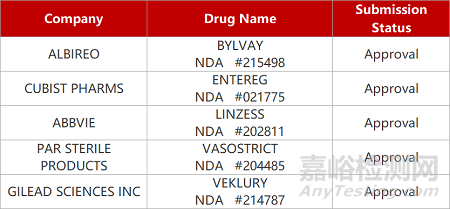
1.益普生ISBT抑制剂获FDA批准新适应症。益普生强效、非全身性回肠胆汁酸转运抑制剂(IBATi)Bylvay(odevixibat)获FDA批准新适应症,用于治疗12个月及以上Alagille综合征(ALGS)患者的胆汁淤积性瘙痒。这是一种常染色体显性遗传病,也是婴儿期慢性胆汁淤积性肝病的重要原因之一。在III期ASSERT研究中,odevixibat达到改善瘙痒的主要终点和减少血清胆汁酸的关键次要终点。
2.利那洛肽获FDA批准用于儿童便秘。Ironwood公司鸟苷酸环化酶-C(GC-C)激动剂Linzess(linaclotide,利那洛肽)新适应症获FDA批准,用于治疗6~17岁儿童功能性便秘(FC)。在Ⅲ期临床中,linaclotide较安慰剂显著改善患者的自发肠道运动频率(SBMs/周),两组患者12周时SBMs值从基线起最小二乘均值分别改变2.220和1.050。此前,linaclotide已被FDA批准用于治疗成人便秘型肠易激综合征与慢性特发性便秘。
3.CD3-ADC联合治疗cHL的II期临床积极。Seagen公司CD30-ADC药物维布妥昔单抗(brentuximab vedotin,Adcetris)与PD-1抑制剂Opdivo和标准化疗药物多柔比星和达卡巴嗪(AN+AD)联用,一线治疗早期经典型霍奇金淋巴瘤(cHL)的Ⅱ期试验(SGN35-027)结果积极。C部分结果显示,联合治疗达到98%(95% CI:94.3-99.6)的总缓解率,完全缓解率为93%(95% CI:87.3-96.3)。观察到的免疫介导不良事件与Opdivo的单药安全性特征一致。
4.口服免疫疗法过敏早期临床积极。Alladapt Immunotherapeutics公司口服免疫疗法ADP101治疗儿童食物过敏的Ⅰ/Ⅱ期临床结果积极。ADP101包含多种过敏原,涵盖9个(包括奶,蛋,小麦,鱼类,贝壳类海产,花生,坚果,豆类和芝麻)引发食物过敏反应的食品类别。试验结果显示,在患有单一或多种食物过敏的儿科患者中,ADP101提供剂量依赖性,具有临床意义的脱敏反应,并具有良好的安全性和耐受性。
5.辉瑞RSV疫苗启动高危儿童队列研究。辉瑞呼吸道合胞病毒(RSV)融合前F蛋白双价疫苗RSVpreF(PF-06928316)在clinicaltrials.gov网站上登记启动一项针对RSV高危儿童(2岁至18岁)的临床试验(PICASSO)。该研究拟纳入1980例受试者,包括I/II/III期三个阶段。据悉,该疫苗在今年5月初也注册了一项针对RSV高危成人群体的III期临床,旨在评估该疫苗用于这群体预防RSV感染的效果,该项研究预计将于明年3月份完成。
6.眼科基因药物公司获9600万英镑融资。Beacon公司宣布获得9600万英镑(约合1.2亿美元)投资,以用于推进其基因治疗产品AGTC-501用于治疗晚期X连锁视网膜色素变性(XLRP)疾病的Ⅱ期临床开发。AGTC-501能正确表达全长的RPGR蛋白,从而解决XLRP引发的全部光感受器损伤问题。此外,所获资金还将用于该公司拟用于治疗干性老年黄斑变性(AMD)AAV基因疗法和结晶样视网膜色素变性(CRD)基因治疗药物的临床前研究。
医药热点
1.杨闽红兼任福建省中医药管理局局长。福建省人民政府近日发布一份人事任免通知,经研究决定,杨闽红兼任福建省中医药管理局局长。根据公开信息,杨闽红,男,汉族,1968年11月生,福建晋江人,中共党员,1991年8月参加工作,在职研究生学历、公共管理硕士,现任福建省卫生健康委员会党组书记、主任。工作分工:主持全面工作。
2.2022年医保基金飞行检查情况公布。6月13日,国家医保局公布2022年度医保基金飞行检查情况。根据公告,2022年全年共组织24个飞检组,抽查了48家定点医疗机构包括三级公立医院40家、三级民营医院3家、二级以下民营医疗机构5家。截至目前,已追回医保基金7.2亿元,对16家定点医疗机构处行政罚款1.2亿元,对7家定点医疗机构处违约金2525.1万元,部分问题仍在进一步复核处理中。
3.我国志愿登记捐献器官人数超626万。6月11日是第7个中国器官捐献日,今年的主题是“目有繁星,沐光而行”。中国器官移植发展基金会理事长赵洪涛在上海市召开的主题活动中指出,2022年我国每百万人口器官捐献率为3.98,相较于国际先进水平还存在一定差距,呼吁全社会营造人体器官志愿捐献的氛围。据悉,目前我国志愿登记捐献器官人数已超626万人。
评审动态
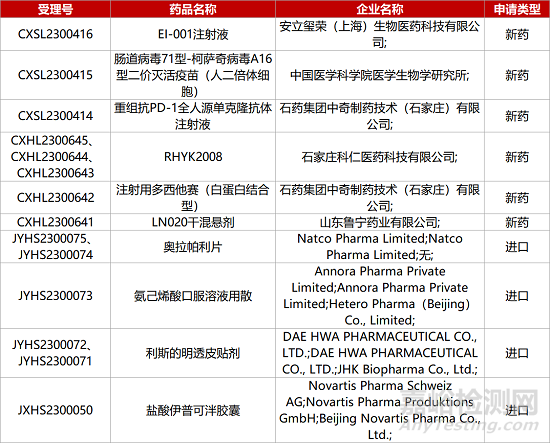
1. CDE新药受理情况(06月14日)
2. FDA新药获批情况(北美06月13日)