您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-13 08:34
医疗器械的设计开发直接关系到产品先天性的安全性和有效性,必须经过严格的控制。本期我们将聚焦于设计开发到生产转化这一重要阶段,深入分析其目的、时机、输入、过程、输出以及相关法规要求,为医疗器械研发同仁提供参考。
No.1 设计转换的目的
1). 设计转换的基本定义
设计转换是将医疗器械的设计输出转化为可重复、稳定生产的过程。它贯穿于设计开发的各个阶段,通过会议会商、样品试制、小批量试产、中试等方法,确保设计意图能够准确、高效地转化为实际生产能力。
2). 设计转换的三大目的
第一个目的(确保可生产性):验证设计输出是否适合大规模生产,确保原材料可获得、生产工艺可行、生产成本可控。
第二个目的(确保产品质量):通过过程验证和确认,确保产品质量稳定可靠,各项质量指标可检测、可监控。
第三个目的(确保法规符合性):满足国内外医疗器械法规对设计转换的要求,例如中国GMP、ISO 13485、美国FDA QSR 820等。
3). 法规条文
①《医疗器械生产质量管理规范》(简称GMP)第三十二条
企业应当在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
②GB/T 42061(itd ISO 13485)7.3.8 设计和开发转换
组织应将设计和开发输出向制造转换的程序形成文件。这些程序应确保设计和开发输出在成为最终生产规范前经验证适合于制造并确保生产能力能满足产品要求。应记录转换的结果和结论。
③美国FDA QSR 820.30 (h) 设计转换
每个制造商应建立和保持程序,确保器械设计正确地转化成生产规范。
No.2 设计转换的时机
设计转换并非一蹴而就,而是贯穿于设计开发的全过程。越早考虑生产转化,后期变更成本越低,产品上市速度越快。
1). 设计策划阶段: 考虑产品实现的生产方式,例如焊接、组装等,评估生产工艺的可行性和成本。
2). 设计输入阶段: 明确产品技术要求、原材料/零部件技术要求、生产环境要求等,为后续生产转化奠定基础。
3). 设计开发阶段:设计开发进行结构设计时,最好是采用通用技术就可以获得的,甚至是市场上可以采购的;反之,如果设计一个很“牛B”结构,最后很难加工制造,则未来的生产成本和质量控制都是很难的,并且越到设计开发的后期,变更的代价越大。
4). 设计输出阶段: 针对每一项设计输出,及时进行设计转换,例如图纸会签、工艺评审等。
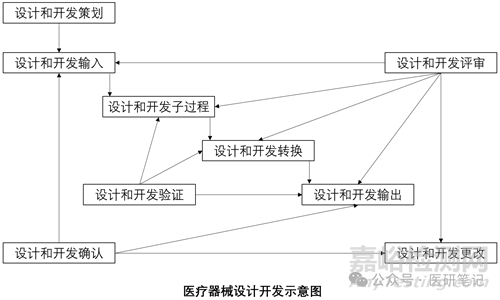
No.3 设计转换完成的时间
1). 产品研发注册阶段的转换
关于设计转换完成的时间节点,法规并未明确规定,业界存在不同观点:
观点一: 注册型式检验前完成主要设计转换活动。理由:注册检验产品应代表批量化、稳定化生产水平。
观点二: 注册型式检验合格后完成设计转换。理由:注册检验报告是设计验证的重要依据。
不管采用哪种观点,公司内部的“设计开发控制程序”需要明确规定,并按照执行。
本人建议: 采用观点一,即在注册型式检验前完成主要设计转换活动,并形成设计转换清单。在注册检测或技术审评过程中发生变更时,及时进行相应的变更和验证。
2). 获得注册证后的转换
好多情况下,设计研发阶段的生产都是小规模。
获得注册后,如果进行规模放大,此时的设计转换也是必须的。
3). 委托生产时的技术转移
委托生产的技术转移,也可视为委托方的设计向受托方生产的转化,这个是一项非常复杂、且法规要求很严的活动,在转换之前,签订《技术质量协议》是必须的。
按照技术质量协议,委托方和受托方各自履行设计转换活动。通常情况下,由受托方制定设计转换的方案/报告,委托方进行批准。
具体的技术转移可以参考《医疗器械委托生产质量协议编制指南(2022年第20号)》,也可以参考本公众号早期的文章《委托方的技术转移》,不作为本期的重点了。
No.4 设计转换的输入
设计转换的输入应来源于经过验证或评审的、已冻结的设计输出,包括但不限于:
a). 产品技术要求;
b). 原材料/零部件技术要求;
c). 半成品的技术规范;
d). 产品图纸;
e). 产品包装图纸;
f). 产品工艺流程图;
g). 产品风险分析报告;
h). 人员的要求;
i). 生产环境的要求。
No.5 设计转换的过程
设计转换方法应根据设计输出的形式和企业技术水平进行选择,常见方法包括:
1). 会商的方法
根据设计转换的目的,可以通过会商的方式进行设计转换,如:
a). 组织经验丰富的采购人员进行会商,完成原材料采购的设计转换,必要时可以邀请供应商参与;
b). 组织经验丰富的生产人员进行会商,完成生产工艺的设计转换;
c). 组织经验丰富的质量检测人员进行会商,完成检测活动的设计转换。
2). 过程验证/确认
在GMP中,工艺流程图中的关键工序和特殊工序转换成最终生产规范,必须进行过程验证和过程确认。
这就要求对IQ、OQ和PQ分别制定方案和形成报告,方可完成设计转换。
3). 样品的试制
也可以采用样品试制的传统方法,进行设计转换。
No.6 设计转换的输出
设计转换活动结束后,应形成以下输出:
a). 检验规程(进货检验规程、过程检验规程、成品检验规程);
b). 生产作业指导书(包括生产环境的要求);
c). 产品包装、标识和储存文件;
d). 生产设备、检验仪器规格表;
e). 产品验证报告;
f). 过程验证报告;
g). 试产报告。
No.7 设计转换的清单
完成所有设计转换活动后,应汇总形成设计转换清单,并经过评审。
设计转换清单应清晰记录各项转换活动的内容、责任人、完成时间、输出文件等信息,为后续生产提供依据。
No.8 总结
设计转换是医疗器械设计开发到生产的关键环节,直接影响产品的质量、成本和上市时间。
企业应高度重视设计转换工作,建立健全设计转换程序,确保设计输出能够顺利转化为可重复、稳定生产的产品,最终实现医疗器械的安全有效。
附:设计转换示例


来源:医研笔记


