摘要
在化学药品注册中,批量以及生产规模放大是药学审评重点关注的问题。本文在对“批”定义进行剖析的基础上,比较了国内外对工艺开发批量的要求,总结了质量研究、稳定性研究、非临床研究、临床研究所用批次的批量要求,并提出了进一步完善我国与批量相关的管理和技术要求的建议。
无论原料药还是制剂,工艺开发的目标是要建立一个能够持续、稳定生产出预期质量产品的商业生产工艺[1-2]。工艺开发一般是从实验室开始,经历生产规模的放大才能实现商业生产。生产规模放大并非物料量的简单倍增,生产场地、生产设备、操作参数、物料来源等诸多方面都有可能随之变更,并对产品质量产生潜在的影响。因此,在药品注册中,注册申报的批量以及生产规模放大是审评机构重点关注的问题之一[1-4]。近年来,随着我国化学药品注册技术要求的不断完善,我国审评机构对药品注册中工艺规模的关注度也在不断提高[5-7],申报批次的制备批量过小已成为当前发补中的常见问题,或是不批准的主要原因之一。为了提高注册效率和成功率,申请人需要准确理解和把握审评机构对于注册批量的要求,关注工艺研发的规模和工艺放大问题。我们梳理比较了国内外监管机构对化学药品注册工艺规模的要求,分析探讨了药品研发中主要研究内容所用样品的批量要求,供业界参考。
一、化学药品注册中的“批”定义
ICH 指导原则将“批( batch 或者 lot) ”定义为“在一个或一系列工艺过程中产生的一定量的、在特定限度内具有均一性的物料”[8],这里的“一定量”就是“批量( batch size) ”。通常,原料药的批量用其实际的批产量来表示,“100 kg 批量”是指每批原料药的产量在 100 kg 左右; 制剂的批量可以用总物料量或者单位制剂的理论得量来表示,例如小容量注射液的批量可以表示为“500 L”( 灌装前的总配液量) 或“10 万支”(灌装量为 5 mL,500 L 的理论灌装量为 10 万支) 。
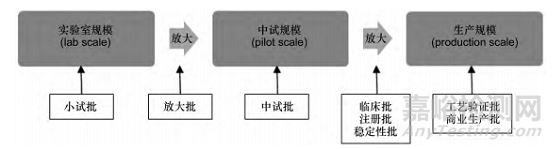
在药品研发和注册中,根据“批”的不同用途和相对批量,又衍生出小试批、中试批、临床批、注册批、商业批等概念。以我国新颁布的《化学药品新注册分类申报资料要求( 试行) 》为例,其中就涉及注册批、商业生产批、临床研究批、中试放大批、生产现场检查批、工艺验证批等概念[7]。尽管各监管机构对衍生出的各种“批”概念所用名词不尽相同,但在定义上均是根据批量和用途的不同予以区分。见图 1。
▲ 图1-药品研发的工艺规模与批次
1.1 根据批量相对大小衍生出的“批”概念
基于生产条件和批量的相对大小,工艺规模大体上可以分为实验室规模、中试规模和生产规模 3 个等级,相对应的“批”分别为小试批、中试批和生产批[9]。小试批(lab scale batch) 是在实验室条件下生产的批次,受实验室设备的限制,批量较小。中试批( pilot scale batch) 是采用中试规模和设备生产的批次,ICH 指导原则将其定义为“采用能够充分代表和模拟将用于最大生产规模的工艺所生产的批次; 对于固体口服制剂,中试规模通常至少为最大生产规模的 1 /10 或者 10 万制剂单位( 片或胶囊) 中的较大者”[10]。生产批( production batch) 对应于生产规模,是在注册申请中界定的生产设施中使用大生产设备生产的批次[10]。
需要注意的是,工艺规模只是针对具体产品反映批量相对大小的一个概念。对一个产品而言,各规模对应的批量不是唯一的,例如一个片剂,其生产规模可能有 25,50,100 万片等多种批量; 对于不同产品而言,各规模对应的批量也不具可比性,例如同为生产规模,一些原料药的批量可能达到几百公斤,而也有一些原料药可能仅有几十克。
另外,在药品研发过程中,根据产品和工艺特点,在小试批和中试批之间、中试批和大生产批之间还可能有中间状态的放大批( scale-up batch) ; 在一些情况下,例如商业生产的批量较小,或者产品的生产工艺非常简单,也有可能不需要经过中试放大,直接从实验室规模过渡到生产规模。
1.2 根据用途不同衍生出的“批”概念
根据“批”的用途不同又衍生出临床批、工艺验证批、商业批等概念,监管机构通常会对不同用途的批次提出各自的批量要求。例如,临床批 ( clinical batch,或 者biobatch) 是指用于临床研究、人体生物利用度或生物等效性等研究的批次,至少需要中试以上规模[11]。在传统工艺验证理念下,工艺验证批( process validation batch) 是指在商业生产前,为验证工艺,按照确定的生产工艺在商业生产规模上所生产的批次。商业批( commercial batch) 是指药品获准上市后,采用生产规模生产并用于商业销售的批次。
国际上将用于正稳定性研究的批次称为“primary batch”或者“primary stability batch”,从这些批次中产生的稳定性数据用于支持建立原料药的再检验期或制剂的有效期[10]; 在我国颁布的《化学药物( 原料药和制剂) 稳定性研究技术指导原则》中,则将这些用于正式稳定性研究的批次称为“注册批”[12]。另外,在我国颁布的《化学药品新注册分类申报资料要求( 试行) 》等中也提出了“注册批”概念[6-7],但未给出“注册批”的明确定义,从指导原则内容来看,此处的“注册批”与上述稳定性研究技术指导原则中的“注册批”内涵不完全相同,而和 FDA 指导原则中所指的“展示批( exhibit batch) ”[13-15]含义较为接近,这些批次的工艺信息、生产数据、中间体和成品检验结果等都是支持注册申请的重要信息; 这些批次如果符合稳定性研究对批次的要求并用于正式的稳定性研究,方能称之为“primary batch”。
在研发过程中,同一批次可以有多种用途。例如,只要能够符合法规、指导原则对相关研究所用批次的规定和要求,“注册批”可以用于稳定性、生物等效性或临床等研究。需要指出的是,我国一些申请人经常在中试规模生产“注册批”时同步开展工艺验证,并把“注册批”也称为“工艺验证批”。尽管采用中试规模开展的工艺验证研究可以视为工艺验证生命周期的组成部分,但传统意义上的工艺验证通常是在产品上市之前采用生产规模开展,此时产品和工艺开发已经完成,工艺也已经放大到生产规模[16]。由于中试规模的“注册批”并不符合传统工艺验证对批次的要求,称之为“工艺验证批”不够严谨,申请人仍需要按照指导原则要求采用前三批商业生产批开展工艺验证[7]。
二、国内外对化学药品注册工艺规模的要求
尽管工艺放大对产品质量可能产生影响,但这并不意味着,药品注册申报时一定要提供商业生产规模的研究资料。考虑到工艺放大的时间成本等问题,为缩短产品上市时间,监管机构往往要求在提交新药申请( NDA) 或者仿制药申请( ANDA) 时提供的工艺研究信息达到中试规模即可。
2.1 国际上对化学药品注册工艺规模的要求
ICH 相关指导原则[1-3]中没有要求在提交创新药注册申请时提供生产规模的研究数据,但要求工艺研究的规模应达到中试或以上。世界卫生组织( WHO) 在其仿制药相关指导原则中也明确说明,如果提供的工艺信息能够代表生产规模,同时承诺在工艺规模放大时按照变更指导原则的要求及时向 WHO报告,提供中试规模的工艺信息是可以接受的[17]。
美国 FDA 的相关技术文件[14-15,18-20]更为清晰地说明了递交仿制药注册申请时对工艺信息的要求。一般而言,在仿制药注册申请时需要提交中试或以上规模生产的展示批( exhibit batch) 信息,明确拟定的商业生产批量,说明商业生产规模与展示批在批量上的差异,以及二者所用设备在设计和操作原理方面的异同,并提交工艺放大计划。为了帮助审评员判断所提交的工艺能否从展示批放大到生产规模并保持产品质量的一致性,以及在后续商业生产中工艺和产品质量的一致性,FDA 要求申请人提交详细的工艺开发报告以证明申请人对生产工艺有充分的理解。FDA 希望在注册申报资料中能够固定生产过程检验、终产品放行标准以及工艺描述,但是允许申请人在从展示批向生产规模的放大过程中对操作参数( 例如时间、流速、温度等) 进行调整,以满足上述已固定的各项要求。FDA 要求申请人在申报资料中说明拟采用的商业生产规模的操作参数,并与关键批次( 例如用于生物等效性研究的展示批) 的相应参数进行比较、分析。对于拟采用的生产规模的操作参数,申请人在申报时既可以将其固定下来,也可以说明目前仅是临时参数,将根据后续放大研究进行调整。见表 1。
▲ 表1-FDA 对不同规模工艺参数的比较要求
总体而言,以 FDA、EMA 为代表的国外监管机构并不强制要求在注册申请时提交生产规模的研究数据,但非常关注申报批次的批量与商业生产规模的批量差异,以及工艺放大的风险评估和风险管理[9,16,18-21]。为了有效控制用较小规模(例如中试规模) 研究数据支持产品注册的潜在风险,这些监管机构除强调注册申请资料中相关工艺研究信息的提交要求外,更重要的是针对上市后生产规模放大建立了较为完善的监管措施[22-25]。
2.2 我国对化学药品注册工艺规模的要求
我国于 2005 年颁布的相关技术指导原则中阐述了化学原料药和制剂的工艺放大研究要求,但没有明确注册申报时对工艺规模的要求,也没有明晰“中试规模”的定义[26-27]。由于指导原则对注册申报的工艺规模缺少明确要求,加之当时我国药品研发机构对工艺研究包括规模问题的重要性认识不足,一些申报品种的研制规模很小,对工艺的认知不够深入,导致申报工艺不能顺利过渡到商业生产,在产品获批后,需要另起炉灶重新开发适合商业生产的工艺,加之后续的变更管理没有跟上,造成申报工艺与实际生产工艺不一致的问题。
随着我国药品研发水平的提升,对工艺规模的重要性有了新的认知。2008 年颁布的《化学药品技术标准》提出了“规模化生产的可行性”问题,强调“原料药的制备工艺研究应在一定规模下开展,所取得的研究数据( 包括工艺条件、工艺参数、起始原料和中间体的质量控制要求等) 应能直接用于或指导原料药的工业化生产”,对于制剂也要求“临床试验( 含生物等效性试验) 用样品的处方工艺应与实际生产产品的处方工艺一致,现制备规模下的产品质量应能代表工业化生产的产品质量”,对于工艺规模过小的原料药和制剂申请不予批准[5]。该要求的颁布使研发人员和审评人员逐渐开始重视工艺规模问题。
2010 年我国开始对部分化学药品注册申请试行 CTD 格式申报,引入了“注册批”、“大生产的拟定批量范围”等概念[6],技术审评中对批量问题的重视程度进一步提高,开始关注生产工艺开发过程中的规模变化及其对产品质量的影响、注册申报规模与拟定商业生产规模的差异及其潜在风险等,这与国际上对工艺规模的要求逐渐趋于一致。最近颁布的《化学药品新注册分类申报资料要求( 试行) 》,对于新注册分类 1、2、3 和 5.1 仍延续了上述表述和要求,允许注册批规模与拟定的大生产规模存在一定差距; 对于新注册分类 4 及 5.2,则进一步提高了要求,明确提出“拟定的大生产的批量范围不能超出研发过程中的最大生产批量”,否则需要提供充分的放大研究与验证的依据。另外,该申报资料要求中也对“中试规模”进行了定义,无论原料药和制剂,要求中试规模的批量至少为商业化生产规模的1 /10[7],这与国际上通用的定义有所不同。
三、一些研究用样品的批量要求
为了保证商业生产产品与研发过程中关键批次样品的质量、安全性、有效性保持一致,监管机构对药品研发中用于关键的药学、非临床和临床研究的样品批量往往也会提出要求。
3.1 质量研究
“质量研究”是我国药品注册中沿用多年的一个概念,其内容包括确定研究项目、建立检测方法并进行方法学验证、制订质量标准并建立各检测项目的限度要求等。我国指导原则要求“药物质量研究一般需采用试制的多批样品进行,其工艺和质量应稳定”,临床前的质量研究工作要求采用“一定规模制备的样品( 至少 3 批) ”进行,临床研究期间对“中试或工业化生产规模的多批样品”进行质量研究工作[28]。ICH 以及 FDA,EMA 等发布的技术文件中没有出现“质量研究”的概念,与我国“质量研究”相对应的研究内容包括杂质、残留溶剂、重金属研究以及分析方法验证、质量标准制定等,与之相关的指导原则中也没有特别明确对研究用样品规模的要求。
对于分析方法验证,其部分内容例如专属性、准确度可能和所用样品的生产规模相关,这是由于生产规模的变化可能导致杂质谱的变化,或者引起制剂处方等方面的关联变更,进而影响方法的专属性、准确度,而其他一些验证内容例如线性、范围、定量限等则与样品的生产规模不相关。因此,如果采用较小规模生产的样品进行分析方法开发及方法验证,当生产规模放大时,需要评估规模变化及其他关联变更对分析方法的影响,必要时对分析方法的专属性、准确度等进行确认或再验证。如果规模的变化导致产品中出现了新的需要单独控制的杂质,则需要针对这些杂质进行方法的全验证。
不同规模、不同用途样品的批分析数据是建立质量标准限度的重要依据之一。对于早期研发阶段的创新药,由于生产规模较小,更多是依据小规模生产的非临床/临床批次样品的检测数据,结合相关的开发数据、药典和指导原则要求等来制订限度; 在NDA 和 ANDA 申请中,检测项目及限度的设定则要充分考虑放大规模生产样品的检测结果和稳定性数据[29]。
3.2 稳定性研究
对于药品注册申报时正式稳定性研究所用样品的生产规模要求,我国与 ICH 基本一致,其中原料药应包括至少 3 批中试或以上规模生产的样品,新制剂的 2 批样品应在中试或以上规模,第 3 批规模可以小一些[10,12]。对于仿制制剂( 新注册分类 4 及 5.2) ,我国的最新要求是稳定性批次均应达到中试或以上规模[7],而国际上则多沿用新制剂的要求。例如,FDA 要求仿制药中的口服制剂,稳定性研究批次中至少 2 个批次达到中试或以上规模,第 3 个较小批次可以小于拟定大生产规模的 10% ,但不能低于中试规模的 25%[30]。WHO的要求相对更低,仿制制剂的稳定性研究仅需采用每个规格不少于 2 批至少中试规模样品即可; 对于非复杂制 剂( 例如速释固体制剂、非灭菌溶液剂等) ,其中一批的规模可以更小( 例如,对于固体口服制剂 25 000 或 50 000 片/粒) [17]。
需要指出的是,我国颁布的相关指导原则[7,12]中对于中试规模( pilot scale) 的定义和要求与 ICH指导原则存在差异。ICH 指导原则中仅针对固体口服制剂举例,明确中试规模一般是指最大生产规模的 1 /10 或 100 000 个制剂单位中的较大者,而我国的指导原则中对原料药和制剂均明确“批量至少为商业化生产规模的 1 /10”,同时去除了固体口服制剂 10 万个制剂单位的要求。这种变化显然是考虑到中国医药产业市场集中度不高的现状,从可操作性角度而言具有一定合理性。
3.3 非临床研究
创新药研发是一个渐进的过程,大部分的非临床研究在研发早期开展,此时药学研究包括工艺研究尚不成熟,生产规模也比较小,药品注册中对于创新药非临床研究用样品的制备规模没有明确限定。一般而言,在这个阶段,样品的生产规模能够满足相应的非临床和临床研究需求即可,根据具体品种的情况,可以在实验室规模或放大规模下生产研究用样品。
在创新药研发早期阶段,临床研究用样品的质量标准很大程度上要依据非临床研究特别是安全性评价用样品的检测结果设定,对于杂质而言,超过鉴定限的杂质限度原则上不能超出非临床安全性评价样品所含相应杂质的实测结果。在从非临床向临床过渡的过程中,如果生产规模变化过大,杂质谱发生变化的可能性会增大,在确定非临床研究样品生产规模时需要考虑这种风险。
3.4 临床研究
药品注册中,用于支持药品上市的安全性、有效性数据并不是来源于商业生产批次,而是来源于研发过程中的有限批次,例如用于创新药关键的Ⅲ期临床试验或者用于仿制药人体生物等效性试验的批次。药品需要在其生命周期内保持与关键性临床研究所用样品质量的一致性,这是保证商业生产批次产品与临床研究用样品具有相同安全性、有效性的基础,建立关键临床研究批次与商业生产批次之间的质量联接,使二者质量保持一致是药学审评的一个重点关注问题[31]。但是,从临床批次过渡到商业批次可能有诸多方面的变更,包括生产规模的变更,这些变更会对药品质量产生潜在的影响。为了降低或避免这种风险,各监管机构非常关注商业生产批次与关键的临床批次之间在生产工艺包括批量等方面的差异,申请人需要对这种差异进行充分的讨论,分析差异对产品的生产、性能和质量的影响[1-3]。
对于创新药早期研发阶段,临床研究用样品可能在小规模下生产,监管机构会要求申请人提供相关生产信息,但通常不会关心规模的大小。当创新药进入关键的临床研究( 例如Ⅲ期临床研究) ,监管机构开始关注生产规模,此时临床研究用样品的生产规模一般应达到中试或以上规模,以保证与将来商业生产的有效桥接[32-33]。对于仿制药的口服制剂,除非有特别理由,通常要求用于生物等效性研究的样品批量也应达到中试或以上规模,即至少为最大生产规模的 1 /10 或者 10 万制剂单位中的较大者[34-35]。
四、讨论与建议
药品注册的批量问题是当前阶段困扰我国药品研发和审评的一个重要问题,这一问题的产生和我国医药产业的发展现状有很大关系。从研发角度而言,由于我国医药生产企业普遍规模较小,同品种重复申报严重,加上流行病学数据的缺失、诸多政策性因素的影响,申请人在进行研发时很难预测将来的市场占有量,也就很难确定商业生产规模及工艺的研发规模; 另外,研发成本和工艺开发的规模有很大的相关性,由于研发期间制备的产品不能上市销售,为了降低研发成本,申请人不断试探审评机构对于工艺规模要求的底线,尽可能降低工艺研发的规模。从审评角度而言,审评机构需要根据提交的工艺研究、生产及质量控制信息,判断申请人是否能够从现有规模放大到商业生产规模并保持产品质量的一致性,以及是否能够在商业生产中持续稳定地生产出质量一致的产品; 工艺研究越充分,工艺规模越接近商业生产规模,审评机构做出判断的难度越小,风险也越小,因此审评机构希望申请人在注册申报时提供与生产规模较为接近的工艺研发数据。
批量问题实质上是生产规模变更的“风险”问题,完善由研发到生产工艺规模变更的风险控制,有助于申请人与审评机构在批量问题上达成共识。基于前文的分析,我们建议: ① 进一步明晰我国相关法规文件及指导原则中所列出的各种“批”的定义和内涵,包括对规模的要求。② 借鉴其他监管机构做法,要求申请人基于研发期间的数据分析工艺的规模放大效应,并结合类似工艺的经验分析工艺放大的风险,比较研发规模与拟定的生产规模在物料、设备、参数等方面的差异,提出批量放大计划; 审评中应重点关注申报批次和拟定商业生产规模的批量差异及潜在风险,而非聚焦于批量的“绝对大小”。③ 生产规模变更是常见的上市后变更情形之一,但在我国现行法规、指导原则中对上市后生产规模变更的管理要求和技术要求较为模糊,现实中对于上市后的生产规模变更也缺乏有效监管,可考虑在药品注册批准文件中注明现有研发数据可支持的生产规模,同时加强上市后规模变更的管理,根据规模变更对产品质量的影响程度设置不同的管理通道,例如年度报告、备案、补充申请等。
参考文献
[1]ICH.Harmonised Tripartite Guideline Q8(R2):Pharmaceutical development [EB /OL].[2009-08-01]( 2016-05 -11).http: / /www.ich.org/fileadmin /Public _Web_Site/ICH_Products/Guidelines/Quality/Q8_1/Step4/Q8_R2_Guideline.pdf.
[2]ICH.Harmonised Tripartite Guideline Q11 : Development and manufacture of drug substances ( chemical entities and biotechno logical / biological entities) [EB /OL].[2012-05-01]( 2016-05-11) . http: / /www.ich.org /fileadmin /Public_Web_Site / ICH_Products/Guidelines/Quality /Q11 /Q11_Step_4.pdf.
[3]ICH. Harmonised Tripartite Guideline M4Q( R1) : The common technical document for the registration of pharmaceuticals humanuse: quality [EB /OL].[2002-09-12]( 2016-05-11) .http: / /www.ich.org /fileadmin /Public _ Web _ Site / ICH _ Products/CTD /M4_R1_Quality /M4Q__R1_. pdf.
[4]FDA. Manual of policies and procedures: Chemistry Review of Question-based Review ( QbR) Submissions[EB /OL].[2014-11-18]( 2016-04-17) .http://www.fda.gov/downloads/aboutfda/centersoffices/officeofmedicalproductsandtobacco /cder /manualofpoliciesprocedures/ ucm423752.pdf.
[5] 国家食品药品监督管理总局.化学药品技术标准[EB /OL].[2008 -06-03]( 2016-04-21). http: / /www.sda.gov.cn /WS01 /CL0844 /30470.html.
[6] 国家食品药品监督管理总局.化学药品 CTD 格式申报资料撰写要求 [EB /OL].[2010- 09 -25]( 2016 -04-21) .http: / /www.sda.gov.cn /WS01 /CL0844 /54391. html.
[7] 国家食品药品监督管理总局.化学药品新注册分类申报资料要求( 试行) [EB /OL].[2016-05- 04]( 2016-05-04).http: / /www.sda.gov.cn /WS01 /CL0087 /151985.html.
[8] ICH.Harmonised Tripartite Guideline Q7: Good manufacturing practice guide for active pharmaceutical ingredients [EB /OL]-[2000-10-10]( 2016-04-15 ) .http: / /www.ich.org /fileadmin /Public_Web _ Site / ICH _ Products/Guidelines/Quality /Q7 / Step4 /Q7_Guideline- pdf-
[9] EMA.Note for guidance on process validation[EB/OL].[2001-03-01] ( 2016-04-15 ) -http: / /www.ema.europa.eu /docs/en _ GB / document _ library / Scientific _ guideline /2009 /09 /WC500002913.pdf.
[10] ICH.Harmonised Tripartite Guideline Q1A( R2) : Stability testing of new drug substances and products [EB /OL].[2003-02-06]( 2016-04-15 ) .http: //www.ich.org/fileadmin/Public_Web _ Site / ICH _Products/Guidelines/Quality /Q1A _R2 /Step4 /Q1A_R2__Guideline.pdf.
[11] EMA.Guideline on quality of oral modified release products[EB /OL].[2014-03-20](2016-04-21) . http: / /119.90.25.46 /www.ema.europa.eu / docs/en_GB / document_library / Scientific_guideline /2014 /07 /WC500170465.pdf.
[12] 国家食品药品监督管理总局.化学药物( 原料药和制剂) 稳定性研究技术指导原则 [EB /OL]. [2015-02-05]( 2016-04-21).http: / /www.sda. gov. cn/WS01/CL1616/114289. html.
[13] FDA.Guidance for Industry: Powder Blends and Finished Dosage Units — Stratified In-Process Dosage Unit Sampling and Assessment ( Draft guidance) [EB/OL].[2003-10-01](2016-04-21) .http: / /www.fda.gov/ohrms/ dockets/98fr/03d-0493-gdl0001.pdf.
[14] FDA.Quality by Design for ANDAs: An Example for ModifiedRelease Dosage Forms [EB /OL].[2011-12-01]( 2016-04-21) .
http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM286595.pdf.
[15] FDA. Quality by Design for ANDAs: An Example for Immediate-Release Dosage Forms [EB /OL].[2012-04-01]( 2016-04-21 ). http://www.fda.gov/downloads/Drugs/Development ApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM304305.pdf.
[16] EMA.Guideline on process validation for finished products-information and data to be provided in regulatory submissions [EB /OL].[2014-02-27]( 2016-04-21). http: / /www. ema.europa.eu / docs/en_GB / document_library / Scientific_guideline /2014 /02 /WC500162136. pdf.
[17] WHO. Guidelines on submission of documentation for a multisource ( generic) finished pharmaceutical product for the WHO Prequalification of Medicines Programme: quality part [EB /OL].WHO Technical Report Series No. 970,2102. ( 2016-04-21 ).http: / /apps.who.int / prequal /info _ general / documents/TRS970 /TRS_970-Annex4.pdf.
[18] FDA.QbR Frequently asked questions[EB/OL].[2007-06-04]( 2016-04-29 ) .
http://www.fda.gov/downloads/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved /approvalapplications/abbreviatednewdrugapplicationandagenerics/ucm120980.pdf.
[19] FDA.Example quality overall summary [EB/OL].[2009-03-16]( 2016-05-21) .
http://www.fda.gov/downloads/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved /approvalapplications/abbreviatednewdrugapplicationandagenerics/ucm120979. pdf.
[20] FDA.Example quality overall summary [EB/OL].[2009-03-16]( 2016-05- 21).
http://www.fda.gov/downloads/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved/approvalapplications/abbreviatednewdrugapplicationandagenerics/ucm120977.pdf.
[21] ICH.ICH Quality implementation working group points to consider (R2) : ICH-Endorsed Guide for ICH Q8 /Q9 /Q10 Implementation [EB /OL]. [2011-12-06]( 2016-04-1) .http: / /www.ich.org /fileadmin /Public_Web_Site / ICH_Products/Guidelines/Quality /Q8 _ 9 _ 10 _ QAs/PtC /Quality _ IWG _ PtCR2 _6dec2011. pdf.
[22] FDA. Changes to an Approved NDA or ANDA: Questions andAnswers[EB /OL]. [2001-01-01]( 2016-04-21) . http: / /www. fda. gov / downloads/Drugs/GuidanceComplianceRegulatoryInformation /Guidances/UCM122871. pdf.
[23] FDA. SUPAC-IR: Immediate Release Solid Oral Dosage Forms:Scale-up and Postapproval Changes: Chemistry,Manufacturing,and Controls,In Vitro Dissolution Testing,and In Vivo Bioequivalence Documentation [EB /OL].[1995-11-01]( 2016-04-21 ) .
http://wwwfdagovdownloads/Drugs/Guidance ComplianceegulatoryInformation/Guidances/UCM070636. pdf.
[24] FDA.SUPAC-MR: Modified Release Solid Oral Dosage Forms Scale-up and Postapproval Changes: Chemistry,Manufacturing,and Controls; In Vitro Dissolution Testing and In Vivo Bioequivalence Documentation [EB /OL].[1997-09-01]( 2016-04-21 ).http: / /www.fda.gov / downloads/Drugs/Guidance ComplianceRegulatoryInformation /Guidances/UCM070640. pdf.
[25] EMA.. Guideline on the details of the various categories of variations to the terms of marketing authorizations for medicinal products for human use and veterinary medicinal products[EB /OL].[2013-08-02]( 2016-04- 21 ) .
http: / /ec. europa. eu /health/files/eudralex /vol-2 /c_2013_2008 /c_2013_2008_pdf /c_2013_2804_en. pdf.
[26] 国家食品药品监督管理总局. 化学药物原料药制备和结构确证研究的技术指导原则[EB /OL]. [2005-03 -18]( 2016-04-25) . http: / /www. sda. gov. cn /gsz05106 /02. pdf.
[27] 国家食品药品监督管理总局. 化学药物制剂研究基本技术指导原则[EB /OL]. [2005 - 03 - 18]( 2016-04-25 ) . http: / /www. sda. gov. cn /gsz05106 /04. pdf.
[28] 国家食品药品监督管理总局. 化学药物质量标准建立的规范化过程技术指导原则[EB /OL]. [2005- 03-18]( 2016-04-25) . http: / /www. sda. gov. cn /gsz05106 /16. pdf.
[29] ICH. Harmonised Tripartite Guideline Q6A: Specifications: test procedures and acceptance criteria for new drug substances and new drug products: chemical substances [EB /OL].[1999 -10-06]( 2016-04-15 ).
http: / /www.ich.org /fileadmin /Public _ Web _ Site / ICH _ Products/Guidelines/Quality /Q6A /Step4 /Q6Astep4.pdf.
[30] FDA.ANDAs: Stability Testing of Drug Substances and Products-Questions and Answers[EB /OL].[2014-05-01]( 2016-05-15 ).
http: / /www.fda.gov / downloads/ drugs/guidancecomplianceregulatoryinformation /guidances/ ucm366082.pdf.
[31] 陈震. 我国化学药品注册药学研究技术要求的发展[J]. 中国新药杂志,2014,23( 1) : 20 - 24.
[32] FDA.Guideline on the preparation of investigational new drug products ( human and animal) [EB /OL].[1991-03-01]( 2016-05-15 ) .http: / /www. fda. gov / downloads/Drugs/GuidanceComplianceRegulatoryInformation /Guidances/UCM070315. pdf.
[33]FDA.INDs for Phase 2 and Phase 3 Studies: Chemistry,Manufacturing,and Controls Information [EB / OL].[2003-05-01] ( 2016-05-15 ).http: / /www.fda.gov / downloads/Drugs/GuidanceComplianceRegulatoryInformation /Guidances/UCM070567.pdf.
[34] FDA.Bioavailability and Bioequivalence Studies Submitted in NDAs or INDs — General Considerations ( draft guidance) [EB / OL].[2014-03-01](2016-05 -15) .http: / /www.fda.gov / downloads/Drugs/GuidanceComplianceRegulatory Information /Guidances/UCM389370.pdf.
[35]EMA.Guideline on the investigation of bioequivalence[EB /OL].[2010-01-20]( 2016-05-15).http: / /www.ema.europa.eu / docs/en _ GB / document _ library / Scientific _ guideline /2010 /01 /WC500070039.pdf.