今日头条
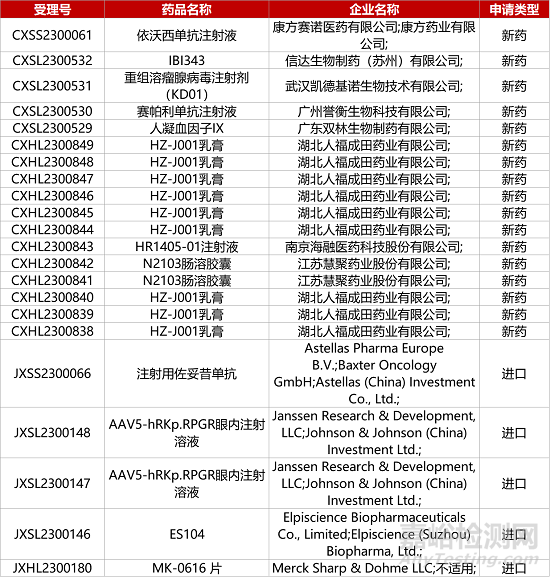
康方PD-1/VEGF双抗报肺癌NDA。康方生物PD-1/VEGF双抗依沃西单抗注射液(AK112)上市申请获CDE受理,推测适应症为用于治疗EGFR-TKI治疗进展的EGFR突变非小细胞肺癌(NSCLC)。目前,AK112正在开展多项III期研究,包括AK112单药对比帕博利珠单抗单药一线治疗PD-L1+的NSCLC的III期研究,AK112联合化疗对比帕博利珠单抗联合化疗一线治疗鳞状NSCLC的III期研究,以及AK112联合化疗与替雷利珠单抗联合化疗在局部晚期或转移性鳞状NSCLC患者中的III期研究等。
国内药讯
1.恒瑞“双艾”组合向FDA报肝癌BLA。恒瑞医药PD-1抑制剂卡瑞利珠单抗(艾瑞卡)联合VEGFR2抑制剂甲磺酸阿帕替尼片(艾坦)(“双艾”组合)一线治疗不可切除或转移性肝细胞癌的生物制品许可申请(BLA)获FDA受理。在国际Ⅲ期CARES-310(SHR-1210-310)研究中,与sorafenib相比,卡瑞利珠单抗组合中位无进展生存期(mPFS)显著改善(5.6个月vs3.7个月);两组中位总生存期(mOS)分别为22.1个月和15.2个月。今年初,“双艾”组合已获NMPA批准用于一线治疗晚期肝细胞癌。
2.安斯泰来Claudin 18.2抗体中国报产。安斯泰来Claudin 18.2抗体zolbetuximab(注射用佐妥昔单抗)的上市申请获CDE受理,用于一线治疗CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃或胃食管交界处(GEJ)腺癌。在Ⅲ期临床GLOW中,与安慰剂联合CAPOX化疗相比,zolbetuximab与CAPOX联合治疗显著改善患者的无进展生存期(8.21个月vs6.80个月)和总生存期(中位OS:14.39个月vs12.16个月)。在美国,该新药用于GEJ腺癌的BLA申请正接受FDA优先审评。
3.康宁杰瑞HER2双抗上Ⅲ期临床。康宁杰瑞与石药集团旗下津曼特生物联合开发的HER2双抗KN026,在联合注射用多西他赛(白蛋白结合型)HB1801用于一线治疗HER2阳性复发转移性乳腺癌的Ⅲ临床研究完成首例患者给药。该项试验拟评估KN026联合HB1801对比曲妥珠单抗联合帕妥珠单抗和多西他赛一线治疗的有效性和安全性。在II期临床中,KN026联合多西他赛达到76.4%的客观缓解率(ORR)。
4.加科思KRAS抑制剂拟纳入胰腺癌突破性品种。加科思KRAS G12C抑制剂格来雷塞(JAB-21822)获CDE拟纳入突破性治疗品种,用于治疗既往经过吉西他滨联合白蛋白紫杉醇或FOLFIRINOX方案治疗后出现疾病进展的KRAS G12C突变的局部晚期或转移性成人胰腺癌患者。值得一提的是,该新药针对KRAS p. G12C突变局部晚期或转移性非小细胞肺癌(NSCLC)的适应症已被CDE纳入突破性治疗品种。
5.药明康德发布2023H1财报。药明康德日前发布2023年半年度财务报告,2023年上半年营收约188.71亿元,同比增长6.28%。公司各业务板块收入:化学业务134.7亿元(+3.8%)、测试业务30.9亿元(+18.7%)、实验室分析与测试服务22.5亿元(+18.8%)、生物学业务12.3亿元(+13.0%)、细胞及基因疗法CTDMO业务7.1亿元(+16.0%)、国内新药研发服务部3.4亿元(-24.9%)。
国际药讯
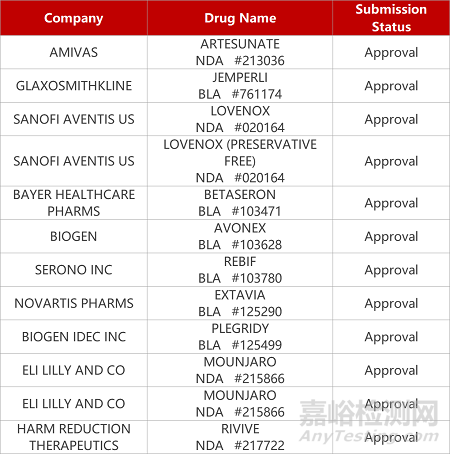
1.葛兰素史克PD-1抗体获批用于子宫内膜癌。葛兰素史克PD-1抑制剂Jemperli(dostarlimab)获FDA批准sBLA申请,与卡铂和紫杉醇联用一线治疗错配修复缺陷型(dMMR)或高度微卫星不稳定性(MSI-H)的原发性晚期或复发性子宫内膜癌。在Ⅲ期临床RUBY中,Jemperli组合将疾病进展或死亡风险降低71%。此前,该新药已获FDA完全批准,用于治疗含铂化疗后进展、携带dMMR的复发或晚期子宫内膜癌患者。
2.Checkpoint公司PD-L1单抗长期疗效数据积极。Checkpoint公司PD-L1抑制剂cosibelimab治疗局部晚期和转移性皮肤鳞状细胞癌(cSCC)的关键研究最新结果积极。在晚期cSCC患者中客观缓解率(ORR)达到55%,在转移性cSCC患者中ORR为50%。药物安全性数据与之前报告保持一致。今年3月,FDA已受理该新药的生物制品许可申请(BLA),用于治疗转移性cSCC或局部晚期cSCC患者,PDUFA日期为2024年1月3日。
3.创新口服TNF-α抑制剂Ⅱ期临床积极。MyMD公司口服肿瘤坏死因子-α(TNF-α)抑制剂MYMD-1在治疗肌肉减少症或年龄相关虚弱造成的慢性炎症患者的Ⅱ期临床中达到主要终点。数据显示,MYMD-1显著降低三种生物标志物TNF-α(P=0.008)、sTNFR1(P=0.02)和IL-6(P=0.03)的血清水平,并在药代动力学评估中维持适当的血浆浓度和参数。研究中未发生治疗相关不良事件(AE)或严重不良事件(SAE)。
4.精分症新药ulotaront两项III期研究失败。住友制药与大冢制药开发的TAAR1/5-HT1AR双重激动剂ulotaront(SEP-363856)用于治疗急性精神分裂症的两项III期DIAMOND 1和DIAMOND 2研究未达到主要终点。在DIAMOND 1研究中,ulotaront (50mg/d和75mg/d)治疗组第6周时患者PANSS(阳性和阴性症状量表)评分较基线分别减少-16.9和-19.6,而安慰剂这一数值为-19.3,不具统计学显著改善。在DIAMOND 2研究中,ulotaront (75mg/d和100mg/d)治疗组PANSS评分分别减少-16.4和-18.1,而安慰剂组为-14.3,也不具统计学意义。ulotaront总体耐受性良好的。
5.新生儿间充质干细胞CD临床前研究积极。美国安-罗伯特劳瑞儿童医院研究团队从手术期间丢弃的心脏组织中提取的新生儿间充质干细胞,在用于直接注射治疗克罗恩病(CD)样回肠炎小鼠模型的临床前研究结果积极。研究发现,这些间充质干细胞可以减少小鼠模型的肠道炎症,促进伤口愈合。这种新的替代治疗方法,可以避免目前克罗恩病药物治疗的缺陷,研究成果发表于Advanced Therapeutics期刊上。
6.第一三共HER2-ADC公布2023Q1业绩。7月31日,第一三共公布2023财年第一季度(4-6月)业绩,总营收3500.8亿日元(约为27亿美元),同比增长25.2%。其中,肿瘤领域明星产品HER2-ADC新药Enhertu总收入866亿日元(6.66亿美元),同比增长49.2%,包括817亿日元(6.28亿美元)全球销售额以及49亿日元(0.38亿美元)预付款和里程碑付款。
医药热点
1.上海精卫中心功能神经外科和中医科病房启用。近日,上海市精神卫生中心功能神经外科和中医科病房正式启用。“近年来,基于电/磁理论发展而来的新型物理治疗技术被广泛应用于精神疾病的疗效探索,如经颅直流电刺激及经颅磁刺激治疗等。”上海市精神卫生中心院长赵敏表示,功能神经外科将探索现代神经调控技术在精神疾病中的临床应用,平台建设具有重要的临床意义及转化医学价值。
2.上海出台改善护理服务三年行动计划。为持续提升患者就医体验,上海市卫健委发布《上海市进一步改善护理服务行动计划(2023-2025年)》,力争用3年时间,开展以“强基础、提质量、促发展”为主题的进一步改善护理服务行动,持续深化“以病人为中心”的理念,为病人提供覆盖全人群全生命周期的护理服务,不断加强临床基础护理,推进上海市护理工作高质量发展。
3.北京佑安医院(保定)肝胆疾病中心成立。7月27日,“首都医科大学附属北京佑安医院(保定)肝胆疾病中心”揭牌仪式在保定市人民医院举行。北京佑安医院党委副书记、院长马迎民在致辞中表示,北京佑安医院将全力支持保定市人民医院提升肝胆疾病的诊疗服务能力,打造北京佑安医院(保定)肝胆疾病中心,构建肝胆疾病全生命周期链条的高质量医疗服务平台。
评审动态
1. CDE新药受理情况(08月01日)
2. FDA新药获批情况(北美07月31日)