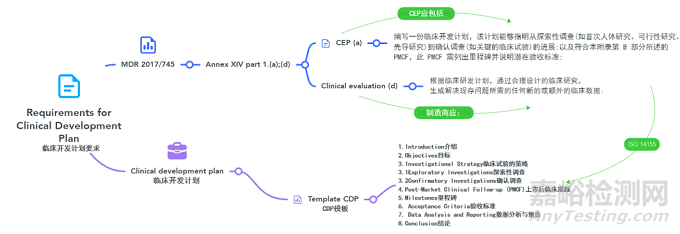
1、临床开发计划介绍
在临床评估医疗器械的背景下,制造商必须根据MDR法规Annex XIV-临床评价和上市后临床跟踪-CLINICAL EVALUATION AND POST-MARKET CLINICAL FOLLOW-UP中概述的规定,在其评估计划中纳入临床开发计划。
重要的是要注意这些是不同的实体。把这种关系想象成一组嵌套的俄罗斯套娃,其中CEP包含了CDP。然而在目前的法规中,临床开发计划(clinical development plan)仅被提及两次,另外请确保要符合ISO 14155。
2、I. General purpose
在本节中,制造商将简要概述正在考虑的医疗器械及其预期用途。此外,制造商将强调制定符合MDR法规要求的全面临床开发计划的重要性。
介绍为后续临床开发计划的制定奠定了基础,展示了其在确保医疗器械的安全性、有效性和合规性方面的重要作用。
在传达器械的预期用途时,强调清晰和精确的重要性。这一初始背景将为理解临床开发计划的后续部分奠定基础。此外,强调MDR法规定义的监管环境,这需要创建一个细致而彻底的临床开发计划,以满足最高的评估和批准标准。
Tips:使用ISO 14155:2020中概述的要求
3、I. General purpose
在本节中,制造商将简要概述正在考虑的医疗器械及其预期用途。此外,制造商将强调制定符合MDR法规要求的全面临床开发计划的重要性。
介绍为后续临床开发计划的制定奠定了基础,展示了其在确保医疗器械的安全性、有效性和合规性方面的重要作用。
在传达器械的预期用途时,强调清晰和精确的重要性。这一初始背景将为理解临床开发计划的后续部分奠定基础。此外,强调MDR法规定义的监管环境,这需要创建一个细致而彻底的临床开发计划,以满足最高的评估和批准标准。
Tips:使用ISO 14155:2020中概述的要求
4、II. Objectives
在本节中,制造商将阐明临床开发计划的核心目标。这包括阐明计划的总体目标,并概述从初步探索性调查到后期确认阶段的顺序过渡。制造商的重点将是简洁地描述每个调查的目的,并阐明每个步骤如何有助于证实器械的安全性和性能。
临床开发计划的主要目标是建立一个系统的框架,指导调查从探索性阶段确认的发展阶段。每项调查都是故意设计的,以阐明器械的安全性、有效性和整体性能的特定方面,确保其无缝整合到临床实践中。
Exploratory Investigations/探索性调查:
探索性调查包括首次人体研究、可行性评估和试点研究等活动。这些调查的目的是初步了解器械的潜在好处和局限性。通过将器械置于受控环境和有限的患者人群中,试图确定任何潜在的安全问题,并为后续阶段完善调查方法。这些探索性研究对于形成随后的确证性研究至关重要,确保所采取的路径是明智的和战略性的。
Confirmatory Investigations/确证性研究:
随着计划的推进,焦点转向确证性研究,其中包括关键的临床研究。这些研究旨在严格评估器械的安全性、有效性和在更广泛的患者范围内的表现。目的有两个:验证器械的预期用途,并产生强有力的临床证据来证实其声明。通过采用控制方案、不同的患者群体和全面的数据收集,确保器械的安全性和有效性是完善的,为监管批准和随后的临床实施奠定了基础。
探索阶段提供了一个基本的理解,塑造了随后严格评估器械属性的确认阶段。我们精心安排了从探索性研究到确证性研究的无缝进展,以确保科学合理且具有临床意义的证据不断积累。这一战略顺序旨在建立器械的可信度,促进监管机构、医疗保健专业人员和患者之间的信任。
5、III. Investigational Strategy
在本部分中,制造商将详细阐述进行临床研究的策略方法。这需要有系统地分解调查阶段,包括探索性和确认性阶段。每个阶段的计划,目标,和方法将被阐述。
3.1 Exploratory Investigations/探索性调查
在探索性研究领域,该计划需要启动初步研究,如首次人体试验、可行性评估和试点研究。这些初步调查是揭示器械潜力、识别挑战和完善调查途径的关键垫脚石。
实例:
First-in-Human Studies/首次人体试验(FIH): 最初的探索阶段将包括首次人体研究,旨在评估器械在有限患者群体中的安全性、耐受性和初步疗效。该研究阶段将涉及[预期数量]患者,重点关注器械的直接影响,并确定任何不可预见的不良事件。终点将包括安全性、基本器械功能和临床有效性的早期指征。
Feasibility Studies/可行性研究:随后将进行可行性研究,包括更广泛的可控患者队列。主要目的是评估器械在现实临床环境中的可行性,微调操作方面,并收集临床表现的初步数据。本试验将纳入大约[预期数量]的患者,终点将扩展到易用性、患者接受度和潜在获益等因素。
Pilot Studies/先导性研究:随后,先导性研究将进一步完善研究策略。有了[预期数量]的参与者,这些研究将侧重于优化方案、数据收集方法和分析程序。本文的重点转向收集更全面的数据,为随后的确证性研究设计提供信息。端点将与关键的研究,尽管规模较小。
3.2 Confirmatory Investigations/确证性调查
进入确认阶段后,随着关键临床研究占据中心地位,研究性方法将加强。这些研究对于确认器械的安全性、有效性和在受控但具有代表性的条件下的整体性能至关重要。
实例:
Study Design/研究设计:验证阶段将采用随机、双盲、安慰剂对照设计,纳入与预期目标人群相似的多样化患者人群。这种稳健的方法允许对器械的性能进行公正的评估,同时坚持严格的科学标准。这项研究将进行跨多个中心加强普遍性。
Endpoints/终点:主要终点将侧重于疗效、安全性和临床效用的可量化指标。这些终点将根据器械的预期用途及其对患者预后的预期影响进行仔细选择。次要终点将为患者报告的结果和长期器械性能提供补充见解。
Inclusion/Exclusion Criteria 纳入/排除标准:制定明确的纳入和排除标准,以确保纳入具有代表性的患者资料,同时排除混杂因素。这种方法保证了研究结果反映了现实世界的情况,并彻底评估了器械的安全性和有效性。
所选择的研究策略是由精心设计的计划所驱动,该计划将探索性见解与确证性研究的严格要求相结合。通过坚持这一战略蓝图,我们的目标是产生强有力的临床证据,证明该器械的安全性、有效性,并符合MDR法规的严格要求。
6、IV. 4. Post-Market Clinical Follow-up (PMCF)
本节深入研究执行上市后临床跟踪(PMCF)研究的综合计划,如MDR法规 AnnexXIV的Part B所述。它概述了目标,方法,数据收集策略,以及PMCF在真实临床环境中器械性能持续评估中的关键作用。
Explain the Plan/解释计划:PMCF研究是整体临床开发战略不可或缺的组成部分,旨在监测器械上市后的实际性能。其目的是收集补充临床数据,验证器械的长期安全性和有效性,并识别在上市前评估阶段可能不明显的任何潜在新风险或益处。
4.1 Objectives/目标
PMCF研究的核心目标包括:
•长期安全性评估:在不同的患者群体中持续评估器械的安全性。
•性能验证:在不同的临床情况下,验证器械的持续有效性及其对预期临床目的的依从性。
•识别新出现的问题:检测任何以前未检测到的不良事件、设备相关并发症或在实际使用过程中可能出现的益处。
4.2 Methodologies/方法
PMCF studies将采用多中心、前瞻性设计,以确保结果的稳健性和普遍适用性。将模拟真实世界的临床环境,涉及更广泛和更多样化的患者人群。这将能够收集反映器械在实际操作中的性能的代表性数据。
•Data Collection Methods/数据收集方法:数据收集将是多方面的,包括患者报告的结果、临床评估和设备特定指标的组合。病人的经历、治疗结果和潜在的并发症将被记录下来,以评估器械对病人生活质量和整体健康的影响。
•Role of PMCF/PMCF的作用:PMCF在确保器械在初始市场进入后的性能持续评估方面起着关键作用。它通过识别增强的领域,解决任何不可预见的问题,并根据实际数据改进器械的功能,从而促进持续改进。从PMCF研究中获得的见解为监管机构、医疗保健提供者和患者提供了信息,有助于提高患者安全性和器械的整体临床效用。
7、V. Milestones
本节概述了每个调查阶段的关键里程碑的时间轴,提供了项目进展的结构化概述。它包括探索性和确证性研究的估计开始和结束日期。此外,它提出了上市后临床跟踪PMCF研究的预期执行时间。
5.1 Exploratory Investigations/探索性调查
First-in-Human Studies: [Name] [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
Feasibility Studies: [Name] [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
Pilot Studies: [Name] [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
5.2 Confirmatory Investigations/确认性调查
Pivotal Clinical Studies: [Name] [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
Data Analysis and Interpretation: [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
Study Planning and Protocol Development: [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
Recruitment and Data Collection: [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
Data Analysis and Reporting: [Description]
Estimated Start Date: [Month, Year]
Estimated Completion Date: [Month, Year]
上述里程碑为及时执行各研究阶段和总体临床开发计划提供了路线图。预计时间表允许全面了解项目的持续时间,并促进有效的项目管理。遵守这些里程碑将确保在研究阶段的简化进展,最终产生强有力的临床证据,证明器械的安全性、有效性和遵守MDR法规中规定的标准。
8、VI. Acceptance Criteria
本部分概述了每个研究阶段的预先定义的接受标准,阐明了表明每个研究成功完成和为进入下一阶段做好准备的标准。清晰且定义明确的验收标准可作为基准,以确保每个研究阶段都得到严格执行,并与总体临床开发计划保持一致。
6.1 Exploratory Investigations/探索性调查
1.首次人体试验FIH研究/First-in-Human Studies
验收标准:成功完成需要安全数据的收集,潜在不良事件的识别,以及对器械功能和可行性的初步了解。本试验未发生严重不良事件,且患者耐受性良好,这表明患者已为下一阶段做好准备。
2. 可行性研究/Feasibility Studies
验收标准:成功完成的标志是操作挑战的识别,调查方法的可行性评估,以及证明器械临床潜力的初步数据。收购价值的可行性见解和一个可行的操作策略表示试点研究的准备。
3.试点研究/Pilot Studies
验收标准:成功完成包括数据收集方法的改进,基于试验数据的方案调整,以及在受控环境下对器械性能趋势的理解。稳健的数据收集过程和有前景的初步研究结果表明,我们为确证性研究做好了准备。
6.2 Confirmatory Investigations/确认性调查
1. 关键临床研究/Pivotal Clinical Studies
验收标准:成功完成需要全面的数据收集、统计分析和生成强有力的证据来支持器械的安全性和有效性。对于主要终点,达到预先设定的统计学显著性阈值并证明患者结局良好将意味着该阶段的成功实施。
2. 数据分析与解读/
Data Analysis and Interpretation
验收标准:成功完成包括彻底的数据分析,主要和次要终点的统计验证,以及与器械预期用途相一致的临床证据的综合。如果结果的解读符合预先设定的成功标准和目标,将表明准备好参加PMCF研究。
6.3 Post-Market Clinical Follow-up (PMCF) Study
1. 研究计划和方案制定/
Study Planning and Protocol Development
接受标准:成功完成包括制定全面的PMCF研究方案、确定适当的终点和明确的患者人群。研究方案与监管要求的一致性以及利益相关方的批准为继续执行研究奠定了基础。
2. 招募和数据收集
接受标准:成功完成试验包括招募足够的患者队列、无缝收集数据以及遵循既定方案。达到所需的样本量并获取与研究方案一致的相关临床数据将表明为最终阶段做好准备。
3.数据分析与报告
验收标准:成功完成包括全面的数据分析、研究结果的综合和结果的报告。提供关于器械长期安全性和有效性的结论性证据,加上遵守监管报告要求,标志着PMCF研究目标的实现。
所描述的验收标准为每个调查阶段的成功执行和到后续阶段的过渡提供了一个清晰的路线图。这些标准与监管标准和临床目标保持一致,确保每个阶段的目标都得到满足,并且器械通过临床开发计划的旅程是系统和全面的。
9、VII. Data Analysis and Reporting
在本部分中,制造商将提出一份全面的数据分析计划,包括统计学方法、终点评估和安全性评估。该部分将阐明如何根据相关法规和指南进行数据收集、分析和报告,确保对整个研究阶段产生的临床证据进行严格审查。
7.1 数据分析策略/Data Analysis Strategy
数据分析计划将涉及多方面的方法,包括严格的统计学方法、终点评估和安全性评估。统计分析将用于量化器械的有效性和安全性结果,同时也阐明收集数据中的模式。将根据数据类型和研究设计,并遵循既定的最佳实践,选择严格的统计方法。
7.2 终点评价/Endpoint Evaluation
我们将仔细评估主要和次要终点。与器械预期临床获益直接相关的主要终点,将评估其统计学意义和临床相关性。次要端点,提供补充的见解,将被分析以增强对器械影响的整体理解。
7.3 安全性评估/Safety Assessments
安全性评估将是数据分析的重要组成部分。不良事件、并发症和安全相关趋势将被彻底分析,以评估器械的安全性。该评估将涉及对不同患者群体、用药持续时间和临床场景的安全性数据进行系统检查。
7.4 数据收集、分析和报告过程
Data Collection, Analysis, and Reporting Process
数据收集将遵循严格的方案,以确保一致性和准确性。在分析之前,收集的数据将经过彻底的验证和验证过程。我们将使用统计学工具评估临床结局的显著性,而遵循预先设定的统计学显著性水平将指导结果的解读。
报告过程将包括创建符合适用法规和准则的全面报告。研究结果将透明地提交,展示临床证据的优势和局限性。此外,数据报告的结构将有助于与监管机构、医疗专业人员和其他利益攸关方进行明确沟通。
7.5 法规遵从性和指引/Regulatory Compliance and Guidelines
所有数据分析和报告活动将严格遵守MDR法规 (MDR )和其他相关指南中概述的监管要求。统计学方法的选择、结局的解释和结果的呈现将以这些法规为指导,以确保稳健性、透明度和法规合规性。
10、VIII. Conclusion
本结论部分概括了临床开发计划的关键方面,强调了其综合本质及其在保证器械的安全性和性能方面的关键作用,符合MDR法规的规定。
8.1 本计划的全面性质/
Comprehensive Nature of the Plan
临床开发计划作为精心制作的蓝图,指导器械通过一系列明确定义的研究阶段。通过将探索性调查纳入确证性研究,并在上市后临床跟踪(PMCF)中达到高潮,该计划提供了一种全面的方法来生成可靠的临床证据,以证实器械的预期用途、安全性和有效性。
8.2 在保证器械安全和性能中的作用
临床开发计划的核心是承诺确保患者安全和器械性能。该计划的功能是防范潜在的风险和不确定性,编排一个战略途径,系统地评估器械在不同患者情况下的属性。该计划是创新和患者健康之间的桥梁,使我们能够弥合理论潜力和真实世界疗效之间的差距。
8.3 符合MDR 要求
临床开发计划的制定是由坚定不移地遵守MDR法规中概述的要求驱动的。通过严格遵守这些规定,该计划确保从探索性评估到确证性研究和PMCF的每个调查阶段都符合最高的监管标准。这种一致性不仅对于法规遵从性至关重要,而且对于在监管机构、医疗专业人员和患者等之间灌输信心至关重要。
总之,临床开发计划不仅仅是一种程序义务;这是一项战略要求,支撑着器械从概念到临床现实的旅程。通过精心制定这一计划,我们为严格评估、证实证据以及确保患者安全和福祉奠定了基础。通过其全面的性质和与MDR 要求的一致性,临床开发计划体现了我们对开拓医疗创新的承诺,同时坚持最高的法规遵从和患者护理标准。