您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-09-12 08:21
|
主要内容 |
Recommended Acceptable Intake Limits for Nitrosamine Drug Substance-Related Impurities(NDSRIs) |
Control of Nitrosamine Impurities in Human Drugs Guidance for Industry |
对比说明 |
|
2023年8月指南(指南1) |
2021年2月指南(指南2) |
||
|
介绍 |
一些药物中出现了一种与原料药活性成分结构相关的亚硝胺杂质,这类亚硝胺杂质的结构不是确定和明确的,致癌毒理数据往往也没有报道和研究。因此基于ICH M7推荐的基于科学风险分析的构效关系原则,本指南推荐了一种可预测致癌活性分类方法和限度制定规则,用于这类亚硝胺杂质的分类和限度制定。 |
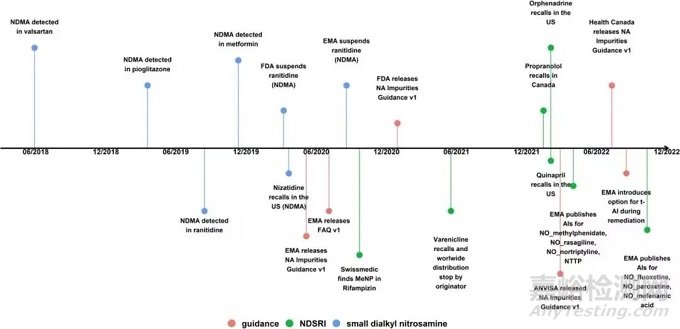
一些血管紧张素 II 受体阻滞剂 (ARB),雷尼替丁,尼扎替丁,和二甲双胍中发现了一类高致癌物质:亚硝胺杂质,如NDMA、NDEA、NMBA等。这类杂质是由于药物生产工艺中使用到了一些含有肿胺和叔胺等结构物质 ,以及含有或残留亚硝酸盐的物质,两者在痕量情况下反应生成一类小分子量、结构明确的亚硝胺杂质。 |
指南1中关注的是结构与原料药活性成分密切相关的亚硝胺,这类化合物结构复杂和致癌活性不明确;指南2关注的是小分子量的NDMA、NDEA、NMBA等亚硝胺,结构明确和致癌活性明确,两个指南相互补充。 |
|
适用范围 |
适用范围包括,处方药、非处方药、仿制药、上市申报的药物、临床使用的药物,以及含有合成片段的生物药;对于符合ICH S9定义的晚期肿瘤的药物不适用于本指南。 |
没有单独定义适用范围,在指南的介绍中给到了适用的药物,包括处方药、非处方药、仿制药、上市申报的药物和临床使用的药物。 |
指南1明确指出对于含有合成片段的生物药也适用,指南2的范围来自于ICH M7,生物药不适用。指南1指出不适用于晚期肿瘤的药物,指南2没有提及,但实际上它的使用范围来自于ICH M7,M7是不适用于ICH S9范畴的晚期肿瘤药物。 |
|
背景 |
与原料药活性成分结构相关的亚硝胺杂质结构复杂,短时间内很难获得其毒理数据,因此对于这类杂质的监管具有挑战性,因此基于对亚硝胺杂质的致癌机理研究,以及ICH M7推荐的构效关系和致癌风险评估,这类杂质的致癌活性可使用构效关系进行预测,从而制定其限度。 |
常见的亚硝胺杂质被报道发现后,导致市场上一些常用药物被要求退出市场;详细介绍了6种常见的亚硝胺杂质和限度,以及它们形成的6种原因。 |
指南1仅说明这类杂质的特殊性和复杂性,以及对于监管带来的新挑战;指南2是首次针对亚硝胺这种类型杂质的指南,详述了亚硝胺杂质的前生今世,以及它导致的后果。 |
|
推荐限度 |
基于构效关系推荐了一种预测致癌活性分类方法,机理是亚硝胺杂质中观察到了α-羟基化的突变致癌机理。该预测方法适用于 N-亚硝基两侧带有碳原子的NDSRI,其中碳不与杂原子直接双键结合(即,排除N-亚硝胺、N-亚硝基脲、N-亚硝基胍和其他相关结构)。此外,该分类方法也不适用于N-亚硝基在芳香环内的NDSRI(例如亚硝化吲哚)。因此基于结构的特点,致癌活性预测将这类亚硝胺杂质分为5个类别,每个类别对应一个限度要求。最高限度为1500ng/天,最低限度为26.5ng/天。 |
小分子量的亚硝胺杂质限度是基于化合物的毒理数据和ICH M7中70年长期使用不超过十万分之一的风险,推荐了6种常见亚硝胺杂质的限度。最低为26.5ng/天, 最高为96ng/天。 |
指南1给到一种化合物预测致癌活性方法,基于构效关系的原理推测化合物的致癌活性,将化合物活性分类,给到不同的限度。
指南2是基于化合物毒理数据和十万分之一的致癌概率,给到了6种常见亚硝胺杂质的限度。
指南1的预测方法解决了与原料药结构相关的亚硝胺杂质的限度制定问题,而不是之前采用一刀切的严格方式,可很大程度缓解这类复杂亚硝胺杂质限度制定的策略。 |
|
药物供应的影响 |
这类亚硝胺主要会在制剂中生成,少许在原料药中产生。因此原料药和制剂的供应商在进行亚硝胺风险评估时都需要纳入这类亚硝胺。目前市场上有少部分药物因为这类杂质导致召回。 |
常见亚硝胺杂质的生成机理清晰,因此在原料药生产过程中要尽量避免这类产生的条件,包括在制剂的生产过程和储存过程中的生成条件。 |
指南1中亚硝胺杂质的产生,与药物结构特点密切相关,它对于药物供应的影响面较小,目前触发召回的药物有普萘洛尔、喹利和奥芬那君。
指南2中亚硝胺杂质的产生,对于市场上的药物供应影响较大,包括常见的药物:沙坦类药物,替丁类药物,二甲双胍等。 |
|
风险评估,包括不同申报阶段的实施时间 |
对于这类杂质实施三步的缓解策略:风险评估、确证性检测和递交变更。
在2023年11月1日之前需要完成风险评估,在2025年8月1日需要完成确证性检测和递交相关变更。 |
对于这类杂质实施三步的缓解策略:风险评估、确证性检测和递交变更。
在2021年3月31日之前需要完成风险评估,在2025年10月1日需要完成确证性检测和递交相关变更。 |
两个指南实施的是相同的三步缓解策略,要求有风险评估,确证性检测和递交变更,并且有对应的完成时间。
制药行业人士目前正在呼吁指南2中要求完成的时间对于企业是有挑战的,希望能延长这个时间。 |
|
附件,限度推导和计算 |
这类特殊的亚硝胺杂质结构较为复杂,有共同点,也有很大的不同点,因此附件中列明了对于这类亚硝胺杂质的预测分类和限度推测。 |
没有附件,限度在正文中直接给定。 |
指南1中增加了附件,清晰说明这类杂南的活性推测。 |
|
总结 |
指南1补充解决了指南2中不常见亚硝胺杂质限度制定。对于制药企业来讲,可以科学分析这类与原料药结构相关的亚硝胺杂质的毒性,而不是以前的一刀切最严格的限度,这是科学监管进步。 |
||

来源:文亮频道


