泰国是东南亚主要的医疗器械市场之一。在泰国,医疗器械受公共卫生部下属的泰国食品和药物管理局(Thai FDA)监管,以确保医疗器械的安全性、有效性和合规性。在医疗器械产品合法引入泰国市场之前,需要在Thai FDA进行注册。
当地的主要法规为Medical Device Act B.E. 2551 (2008)和Medical Device Act (2nd Edition) B.E. 2562 (2019) 等。另外作为东盟ASEAN成员国,泰国也会参考东盟相关法规。
境外制造商首先需要在泰国指定授权当地代理人。注册证有效期为5年,会颁发给该当地代理。目前泰国法规规定不可变更代理人,但同一产品可以同时有多个当地代理人。
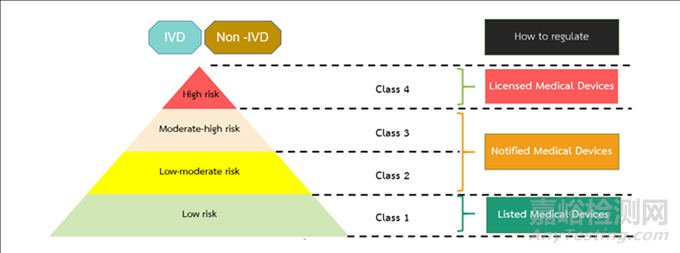
医疗器械(包括IVD)产品的风险分类主要取决于器械的性质和预期用途。在泰国,医疗器械风险等级由低风险向高风险依次分为Class 1, Class 2, Class 3和Class 4四类。
根据风险等级不同,Thai FDA的监管力度也会不同。最低风险的1类产品只需要列名(listing),风险较高的2类和3类产品需要进行通知(Notification),而风险最高的4类产品则需要批准许可(License)。
在泰国主要有三种注册路径:
“简洁路径”(Concise pathway)适用于在参考国家(欧盟、加拿大、日本、澳大利亚、美国或WHO Prequalification)注册过的产品,该产品需要在至少一个参考国家成功注册并上市1年以上,且无严重不良事件。
类似的“信赖计划”(Reliance program)则适用于已在新加坡HSA成功注册的医疗器械产品。
如产品不满足以上两个情况的话,则需要走全流程审批路径(Full evaluation)
所有风险等级的产品技术文件均需参考东盟通用提交档案模板CSDT(Common Submission Dossier Template) 。另外对于2、3、4类产品,需要ISO 13485质量管理体系。
根据不同产品风险等级以及产品的具体情况,泰国注册的时间可能需要0-300天。费用也会从几十美元到4000美元不等。