美国食品和药物管理局 (FDA) 近期发布的最终指南显示,汽化过氧化氢现在承认这是一种既定的灭菌方法。这一变化是该机构减少使用环氧乙烷对医疗器械进行消毒的努力的一部分,因为环境保护署计划对灭菌器实施新的排放限制。
美国食品和药物管理局 (FDA) 器械和放射健康中心战略伙伴关系和技术创新办公室主任苏珊娜·施瓦茨(SuzanneSchwartz) 表示,添加汽化过氧化氢将有助于为灭菌器械建立更具弹性的供应链。
汽化过氧化氢(Vaporized Hydrogen Peroxide,即缩写VHP)灭菌技术,是利用过氧化氢在常温下气体状态比液体状态更具杀孢子能力的优点,经生成游离的羟基,用于进攻细胞成分,包括脂类、蛋白质和DNA,达到完全灭菌要求的一种技术。常用于隔离室、隔离器等密闭空间的灭菌。汽化过氧化氢(VHP)灭菌干燥、作用快速、无毒无残留,物质相容性较好,包括很多金属和塑料,适用于房间、生物安全柜、传递窗、动物笼交换站、隔离器和医疗器械等表面的灭菌消毒。生物净化时间短,根据待处理产品的物理特性,生物灭菌时间30~90min,对更广范围的微生物有效,生物灭菌循环中不产生有毒残留物,对于其他物品影响不大(装置、电器、洁净室墙板等)灭菌所需时间短,容易验证。
1、VHP过氧化氢消毒技术的背景
制药厂传递窗的灭菌方法主要包括消毒液擦拭法、紫外灯照射法、甲醛熏蒸消毒、二氧化氯气体消毒等,这些方法存在可重复性差、难于验证、破坏性大、需消耗大量的人力,以及会危害作业人员的身体健康等特点。过氧化氢已逐渐取代传统灭菌方式,成为表面或空间消毒及灭菌的常用方法,过氧化氢由水和氧气组成,两者均很安全,在杀菌有效性、人员安全性、材料兼容性以及环境有好性方面具有明显优势。
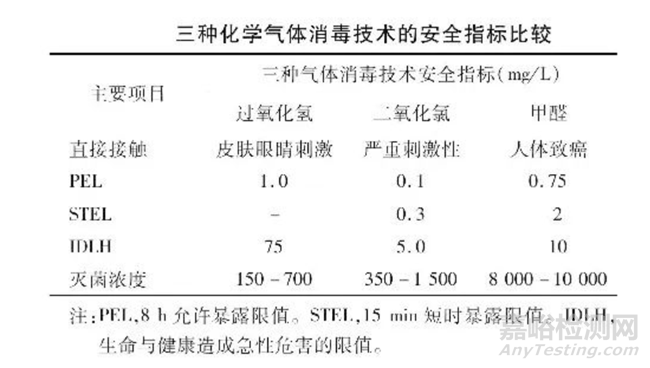
对于人类来说,暴露在一定浓度水平的消毒气体中是有害健康的,这个浓度水平因不同的气体而不同。根据美国职业安全与健康管理局( OSHA)公布的数据,现将甲醛熏蒸、二氧化氯气体、汽化过氧化氢三种消毒技术安全性方面的指标比较见表。
过氧化氢早在100多年前就证明具有良好的杀菌作用,可杀灭各种细菌、真菌、病毒及细菌芽孢,其3.0%水溶液可用于人体皮肤粘膜的局部消毒,6.0%以上浓度可用于耐腐蚀物品的高水平消毒。其杀菌作用原理主要通过氧化作用,以及分解后产生的自由基团,破坏微生物的蛋白质、氨基酸、酶和DNA,破坏微生物的通透性屏障,最终导致微生物死亡。
液体变成气体,需要加温汽化,一般水的汽化温度为100℃,纯的过氧化氢汽化温度为150.2℃,而该技术使用30% - 35%过氧化氢溶液的汽化温度大约为108℃。汽化过氧化氢灭菌技术必须使用一种加热器,或称过氧化氢蒸汽发生器,通过所谓的“闪蒸”将液态过氧化氢转化为VHP,此过程可在常温环境下有效进行。
空气主要由氮气、氧气、水气和少量惰性气体组成。空气中含多少水气肉眼无法直观看到,但是可以通过仪器测定,空气中含水气量的多少,一般用相对湿度( RH)表示。在温度降低时,空气中的水气会形成极小的雾粒,水气越大温度越低,达到“凝露”点时,就会形成露水,沉降下来。
同样的原理,较高温度的VHP被均匀的引入密闭空间,一般维持的VHP气体浓度为150 - 700 mg/L,遇到空间内相对较低温度时,就会形成1微米纳米雾(又称干雾),蒸汽和纳米雾都具有极其容易穿透各种物体的特性,使污染的表面完全暴露于VHP中,附着寄居的微生物表面,在常温下接触到VHP,还会进一步形成微冷凝,理论上冷凝后VHP浓度会迅速升高(水冷凝后浓度100%,VHP冷凝后过氧化氢浓度可达70%以上),并快速杀灭各种微生物。
研究发现当目标环境在VHP循环过程中的浓度达到峰值时,会在所有暴露物体的表面形成一层看不到的沉积物,显微镜下是一个约2μm的冷凝薄膜,产生更为有效的杀灭作用。一旦过氧化氢分子接触到物体表面,即刻产生氧化作用形成自由基攻击微生物,达到高水平的消毒灭菌,并且对细菌、孢子、真菌、霉菌和病毒都广谱有效。
整个过程通过计算机和彩色触摸屏在密闭空间外进行控制,并实时反馈循环进程,被VHP消毒的空间或设备需要密封起来,通过电化学原理的手持式VHP传感器监测没有泄露发生,以及环境是否在循环后恢复至可以进入的安全水平。
2、VHP消毒技术优势
1、安全
使用蒸汽灭菌,在整个灭菌过程中限制人员进入,若灭菌失败可安全复原。
2、可靠
通过汽化过氧化氢灭菌处理,可以使得密封屏障内空气与表面杀菌对数达到4~6,整个灭菌过程简单可靠。
3、智能化
能够实现与建筑设施一体化,与BMS实现控制一体化,整个消毒过程可更换操作人员,降低对操作人员依赖性。
4、标准化
将过氧化氢技术与空调系统结合,能够有效避免传统灭菌难以标准化、验证困难等问题。
3、VHP消毒工作原理
通过高温闪蒸将过氧化氢液体汽化成过氧化氢气体,经高速气流喷射到灭菌空间中,当高温饱和过氧化氢蒸汽接触到较冷的被消毒物品表面时,会形成不可见的微冷凝,通过释放的强氧化自由基(羟基)来攻击病原微生物(破坏细胞膜、脂类、蛋白质和DNA),自由基可对微生物达到log6的快速杀灭效果。灭菌完成后,汽化过氧化氢灭菌设备会自动将环境中的过氧化氢分子分解为水蒸气和氧气,当空间内过氧化氢浓度降至1ppm以下时人员方可重新进入洁净区。
汽化过氧化氢灭菌过程分为以下四个操作阶段:
1、准备阶段
使过氧化氢发生器的蒸发器稳定在约120 -130℃的温度状态,约需5-10 min。
2、进气阶段
使用容易获得的医药级的30% - 35%过氧化氢溶液,在发生器中瞬间蒸发(闪蒸)后动态喷入目标区域,采用喷头提高蒸汽流速以近30 m/s的速度,同时水平及垂直转动以保证均匀的分布。
3、保持阶段
过氧化氢蒸汽在目标区域保持一定的时间范围以确保完全的生物杀灭,此过程使目标区域经过氧化氢蒸汽充分和额外的暴露,以保证得到成功的结果。
4、通风阶段
采用设施的通风系统将蒸汽从目标区域移除,或者兼用通风单元快速催化分解蒸汽为水和氧,在设施的通风系统没有合适的阀门或者不易控制时,采用独立的通风系统将很有意义。
4、验证
验证是中外制药企业GMP管理的重要组成内容。验证的定义最早见于美国食品药品监督管理局FDA公布的《药品工艺检查验收标准》(1978年6月):“一个已验证的工艺系指已能证实按预计或所声称的那样运行的工艺。验证的证据是通过尽可能收集和评估工艺开发阶段的数据,以及以后生产阶段的数据获得的。验证必须包括工艺确认(材料、设备、系统、建筑及人员的确认),以及重复性生产的批或运行的整个工艺的控制”。
我国新颁布的《药品生产质量管理规范(2010年修订)》在第十四章第三百一十二条将验证定义为“证明任何操作规程(或方法)、生产工艺或系统能够达到预期结果的一系列活动”。GMP中验证概念的引入标志着质量管理从“质量检验”提升至“质量保证”,被称为是GMP发展史的里程碑。
无菌药品洁净区域的化学气体熏蒸灭菌,要求其可安全地使用于不锈钢、钢、塑料、玻璃、环氧地面、墙壁等各种表面,并对包括孢子在内的微生物进行快速、有效的灭菌控制,能通过对生物指示剂挑战性试验。
消毒灭菌方法的验证是极其重要的,只有通过验证,才能肯定消毒灭菌方式的有效性和安全性。无菌药品的要求采用了最新的世界卫生组织和欧盟 A、B、C、D 分类,对无菌药品生产的洁净度、级别提出了具体要求,要求达到动态A级的标准,增加了在线监测,特别是对悬浮粒子的静态、动态监测,对浮游菌、沉降菌、生产环境中的微生物和表面微生物的监测都作了详细的规定。