刚刚,国家药监局发布《2023年度医疗器械注册工作报告》,内容如下:
2023年,国家药监局以习近平新时代中国特色社会主义思想和党的二十大精神为指导,全面落实党中央国务院重大决策部署,按照“讲政治、强监管、保安全、促发展、惠民生”的工作思路,继续深化医疗器械审评审批制度改革,全面加强医疗器械注册质量管理,统一规范各级医疗器械审评审批要求,不断夯实医疗器械监管基础,持续推动产业创新高质量发展。
一、医疗器械注册工作情况
(一)医疗器械监管法规制度体系更加完善。2023年9月8日,十四届全国人大常委会将《医疗器械管理法》列入立法规划项目,国家药监局已成立工作领导小组、工作组、专家咨询组,着手起草相关法律文本。会同国家卫生健康委、国家疾控局联合印发《医疗器械紧急使用管理规定(试行)》,为医疗器械紧急使用提供法律支撑。起草《医疗机构临床急需医疗器械临时进口使用管理要求》。
(二)创新医疗器械质量数量实现双丰收。2023年,国家药监局共批准创新医疗器械61个,优先审批医疗器械12个,创新医疗器械批准数量再创新高,比2022年增加6个。在数量增加的同时,创新医疗器械“含金量”不断提升,在全球率先批准通过破坏交感神经治疗肺动脉高压的一次性使用环形肺动脉射频消融导管上市,单光子发射及X射线计算机断层成像系统、腹腔内窥镜单孔手术系统、颅内取栓支架等产品技术达到国际领先水平,更好地满足了公众使用高端医疗器械的需求。
(三)服务国家重大战略稳步实施。大力支持京津冀、长三角、粤港澳大湾区、海南自贸港、福建等重点区域建设。批准人工耳蜗声音处理器等3个海南临床真实世界应用试点产品上市,截至目前,累计批准产品9个,惠及更多患者。指导召开第二届博鳌国际药械真实世界研究大会。指导粤港澳大湾区使用20种、29批次港澳已上市的医疗器械,服务区域诊疗需要。设立医疗器械创新山东、北京、河北、湖北服务站,创新服务站数量已达11个,服务区域产业高质量发展成效初步显现。推进人工智能医疗器械、生物材料创新任务揭榜挂帅工作,共遴选出48个人工智能医疗器械、40个生物材料揭榜项目。筹建高端医疗装备创新合作平台,加速高端医疗器械创新转化速度。完善前置申请机制,加大前置审评辅导力度,9个产品通过辅导已申请注册。
(四)常态化疫情防控保障有力。应急批准广东、北京、江苏3家企业的3个国产体外膜肺氧合系统(ECMO)上市,助力疫情防控“保健康、防重症”目标落实。全年批准新冠病毒检测试剂21个,其中核酸检测试剂9个,抗原检测试剂12个。截至目前累计批准新冠病毒检测试剂157个,充分满足疫情防控需要。协同国家卫生健康委、国家疾控局联合推进猴痘检测试剂产品研发和产品注册上市。持续做好新冠病毒变异株监测和检测试剂能力评估,确保产品有效检出能力。
(五)医疗器械注册备案管理水平显著提升。部署各地开展第二类医疗器械注册清理规范全面整改,召开全国第二类医疗器械注册管理工作会议,印发强化医疗器械注册管理工作意见,部署全面加强注册管理有关工作。对一次性使用微波消融针、重组胶原蛋白创面敷料等,出台相关文件和指导原则,统一规范注册工作要求。指导基层做好第一类医疗器械备案工作。持续规范第一类产品备案,切实加强对市级监管部门的监督指导。
(六)医疗器械临床试验管理力度继续加大。开展27个品种的临床试验产品真实性核查,31个品种的临床试验监督抽查,较2022年数量加倍。发布监督抽查情况通报一期,对存在问题的产品严肃处理,作出不予注册、一年内不予受理的决定。截至2023年底,医疗器械临床试验机构备案数量达到1340家,与2022年相比增加13.8%。
(七)医疗器械标准质量不断提升。修订发布《医疗器械标准报批发布工作细则》《医疗器械标准验证工作细则》,制定《医疗器械标准实施评价工作细则》等文件,标准制修订管理更加精细。成立全国医用防护标准化工作组及口腔数字化医疗器械、医疗器械可靠性与维修性等2个标准化技术归口单位。发布28项医疗器械国家标准、131项行业标准及14项行业标准修改单。截至2022年底,现行有效医疗器械标准共1974项,其中国家标准271项,行业标准1703项,与国际标准一致性程度超过90%,标准体系覆盖性、系统性不断提升。我国主导制定的ISO 24072《输液器进气器件气溶胶细菌截留试验方法》国际标准正式发布,2名中国专家当选国际电工组织(IEC)技术委员会副主席和分技术委员会主席,《人工智能医疗器械 肺部影像辅助分析软件 算法性能测试方法》标准获批国际标准立项。发布《国家药品监督管理局关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告》及两期解读,印发《GB 9706.1-2020标准检验要点》,公开发布41个新版GB 9706系列标准的检验报告模板,建立专家咨询机制,有效推动新版GB 9706系列标准的平稳有序实施。
(八)医疗器械分类管理扎实推进。发布《关于进一步加强和完善医疗器械分类管理工作的意见》,强化分类管理顶层设计。完成医疗器械分类技术委员会换届工作,修订发布《医疗器械分类技术委员会工作规则》。动态调整分类目录,发布《关于调整〈医疗器械分类目录〉部分内容的公告》,涉及58个产品。发布《重组胶原蛋白生物材料命名指导原则》解读,进一步指导和规范医疗器械领域重组胶原蛋白生物材料的命名。组织成立中医(民族医)器械专项工作小组,统筹开展中医(民族医)器械分类、命名、标准、审评、检验、核查等工作。
(九)医疗器械唯一标识工作有序开展。开展唯一标识第一批、第二批实施工作总结,通报先进经验做法。发布《关于做好第三批实施医疗器械唯一标识工作的公告》,将临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗美容相关产品等103种风险较高的第二类医疗器械纳入第三批实施范围。组建医疗器械唯一标识专家咨询团队,为深入推进唯一标识实施工作提供支撑。制定《医疗器械唯一标识的形式和内容》《医疗器械唯一标识的包装实施和应用》两项医疗器械行业标准,进一步指导医疗器械唯一标识工作实施。
(十)监管科学研究工作成果显著。组织推进第二批监管科学6个重点项目13个医疗器械子项目工作,已形成医疗器械监管新工具、新标准、新方法141项。组织药品监管科学体系建设第一批重点项目医疗器械领域重点项目申请和遴选;启动新一代基因测序产品评价方法研究、数字疗法医疗器械质量评价方法研究等9项重点项目。配合开展监管科学研究基地和重点实验室考核,促进研究质量提升。
(十一)医疗器械技术审查能力持续提升。技术审评质量管理体系与业务工作高效融合,审评质量监测、运行和改进体系持续完善。医疗器械注册审评购买服务工作稳步实施。长三角、大湾区审评分中心审评人员数量分别增加176%、109%。全年发布67项指导原则和6项审评要点,现行有效指导原则达到613项,对医疗器械分类目录覆盖率达92.2%。持续开展全系统医疗器械注册管理实务培训、充分发挥实训基地作用,线上举行12期省级医疗器械审评审批人员线上培训,8300余人参训,举办首次省级医疗器械审评员线下实地培训,提升培训效果。公开已发布的GB 9706相关医疗器械标准解读视频,150余万人次在线浏览学习。
二、医疗器械注册申请受理情况
2023年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请共计13260项,与2022年相比增加25.4%。
(一)整体情况
受理境内第三类医疗器械注册申请7106项,受理进口医疗器械注册申请6154项。
按注册品种区分,医疗器械注册申请9968项,体外诊断试剂注册申请3292项。
按注册形式区分,首次注册申请3559项,占全部医疗器械注册申请的27%;延续注册申请4676项,占全部医疗器械注册申请的35%;变更注册申请5025项,占全部医疗器械注册申请的38%。注册形式与数量比例情况见图1。

(二)分项情况
1.境内第三类医疗器械注册受理情况
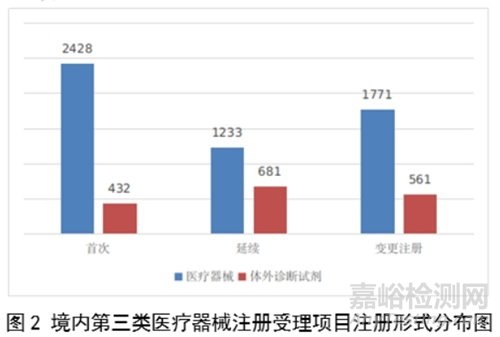
境内第三类医疗器械注册受理共7106项,与2022年相比增加31%。其中,医疗器械注册申请5432项,体外诊断试剂注册申请1674项。
从注册形式看,首次注册2860项,占全部境内第三类医疗器械注册申请数量的40.2%;延续注册1914项,占全部境内第三类医疗器械注册申请数量的26.9%;变更注册2332项,占全部境内第三类医疗器械注册申请数量的32.8%。注册形式分布情况见图2。
2.进口第二类医疗器械注册受理情况
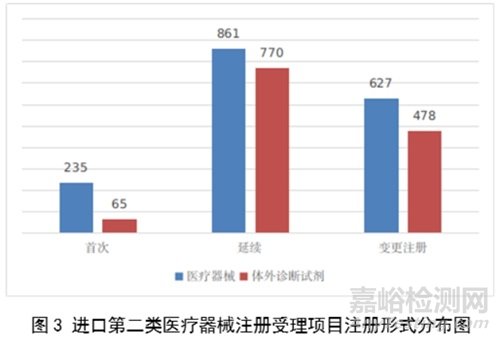
进口第二类医疗器械注册受理共3036项,与2022年相比增加23.1%。其中医疗器械注册申请1723项,体外诊断试剂注册申请1313项。
从注册形式看,首次注册300项,占全部进口第二类医疗器械注册申请数量的9.9%;延续注册1631项,占全部进口第二类医疗器械注册申请数量的53.7%;变更注册1105项,占全部进口第二类医疗器械注册申请数量的36.4%。注册形式分布情况见图3。
3.进口第三类医疗器械注册受理情况
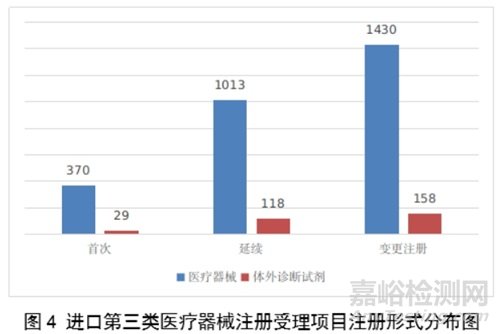
进口第三类医疗器械注册受理共3118项,与2022年相比增加16.4%。其中医疗器械注册申请2813项,体外诊断试剂注册申请305项。
从注册形式看,首次注册399项,占全部进口第三类医疗器械注册申请数量的12.8%;延续注册1131项,占全部进口第三类医疗器械注册申请数量的36.3%;变更注册1588项,占全部进口第三类医疗器械注册申请数量的50.9%。注册形式分布情况见图4。
三、医疗器械注册审批情况
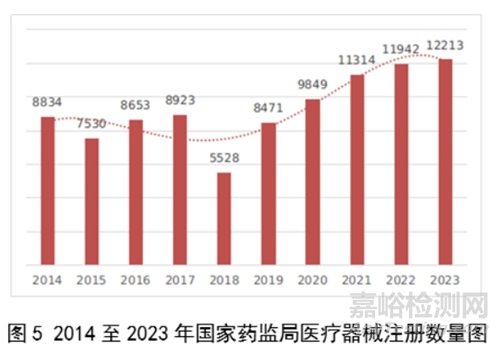
2023年,国家药监局共批准医疗器械首次注册、延续注册和变更注册12213项,与2022年相比注册批准总数量增长2.3%。
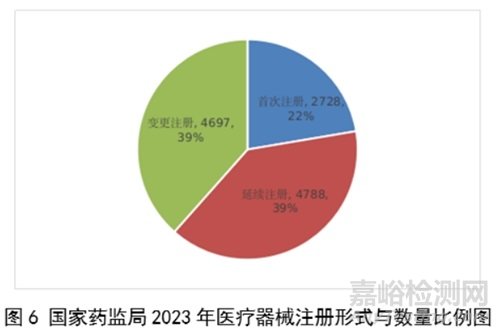
其中,首次注册2728项,与2022年相比增加9.1%。延续注册4788项,与2022年相比减少8.2%,连续两年减少。变更注册4697项,与2022年相比增加11.2%。
2023年,企业自行撤回首次注册申请、自行注销注册证书287项。
近10年国家药监局批准医疗器械注册情况见图5。
(一)整体情况
2023年,国家药监局批准境内第三类医疗器械注册6151项,与2022年相比增加8.1%,进口医疗器械6062项,与2022年相比减少3%。
按照注册品种区分,医疗器械9130项,占全部医疗器械注册数量的74.8%;体外诊断试剂3083项,占全部医疗器械注册数量的25.2%。
按照注册形式区分,首次注册2728项,占全部医疗器械注册数量的22.3%;延续注册4788项,占全部医疗器械注册数量的39.2%;变更注册4697项,占全部医疗器械注册数量的38.5%。注册形式比例情况见图6。
(二)分项情况
1.境内第三类医疗器械注册审批情况
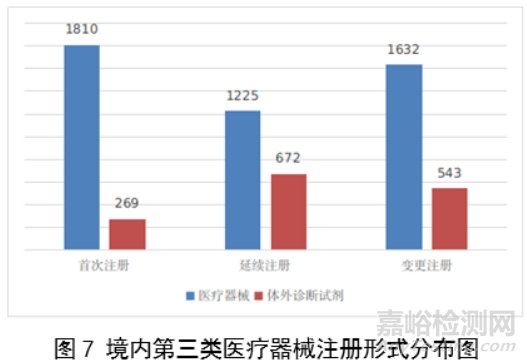
境内第三类医疗器械注册6151项。其中,医疗器械4667项,体外诊断试剂1484项。
从注册形式看,首次注册2079项,占全部境内第三类医疗器械注册数量的33.8%,延续注册1897项,占全部境内第三类医疗器械注册数量的30.8%;许可事项变更注册2175项,占全部境内第三类医疗器械注册数量的35.4%。注册形式分布情况见图7。
2.进口第二类医疗器械注册审批情况
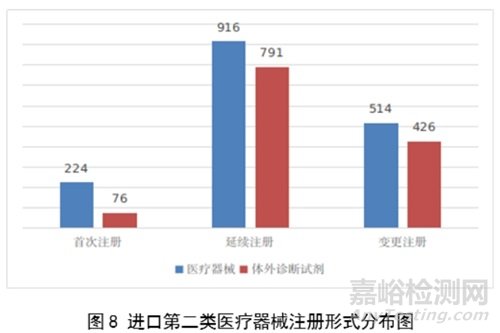
进口第二类医疗器械注2947项。其中,医疗器械注册1654项,体外诊断试剂注册1293项。
从注册形式看,首次注册300项,占全部进口第二类医疗器械注册数量的10.2%;延续注册1707项,占全部进口第二类医疗器械注册数量的57.9%;许可事项变更注册940项,占全部进口第二类医疗器械注册数量的31.8%。注册形式分布情况见图8。
3.进口第三类医疗器械注册审批情况
进口第三类医疗器械注册3115项。其中,医疗器械注册2809项,体外诊断试剂注册306项。
从注册形式看,首次注册349项,占全部进口第三类医疗器械注册数量的11.2%;延续注册1184项,占全部进口第三类医疗器械注册数量的38%;许变更注册1582项,占全部进口第三类医疗器械注册数量的50.8%。注册形式分布情况见图9。
(三)首次注册项目月度审批情况
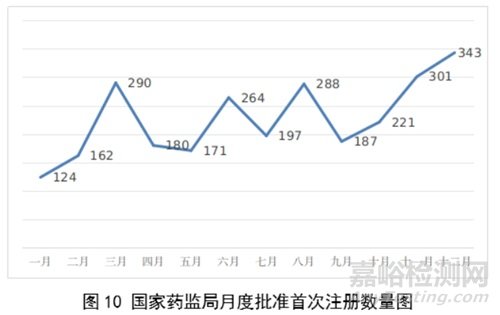
2023年,国家药监局共批准医疗器械首次注册2728项,月度批准数量情况见图10。
(四)具体批准品种种类分析
注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中18个子目录的产品。
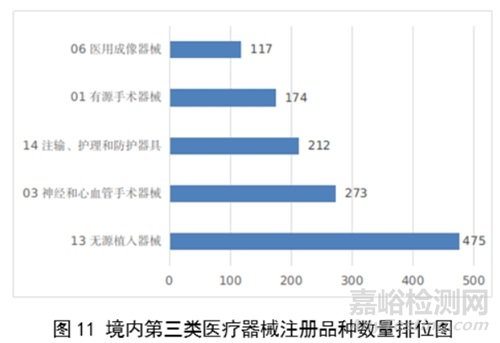
注册数量前五位的境内第三类医疗器械是:无源植入器械,神经和心血管手术器械,注输、护理和防护器械,有源手术器械,医用成像器械。与2022年相比,有源手术器械超过医用成像器械,注册数量同比增加54%,其他品类注册数量也有所增加,如注输、护理和防护器械增加26.2%,神经和心血管手术器械增加11%,无源植入器械增加18.8%。
注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中22个子目录的产品。
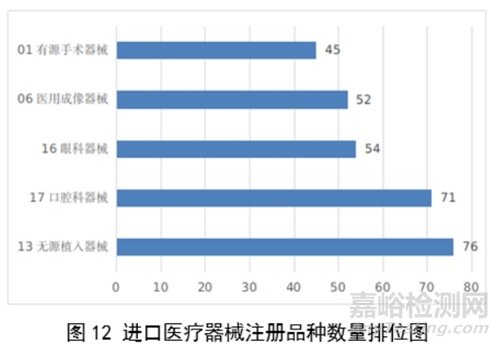
注册数量前五位的进口医疗器械,主要是:无源植入器械,口腔科器械,眼科器械,医用成像器械,有源手术器械,与2022年相比,变化较大,眼科器械取代注输、护理和防护器械,有源手术器械取代神经和心血管手术器械,无源植入器械数量增加43.3%,口腔科器械数量增加57.8%,医用成像器械注册数量减少44.2%。
(五)进口医疗器械国别情况
2022年,共有31个国家(地区)产品在我国获批上市。
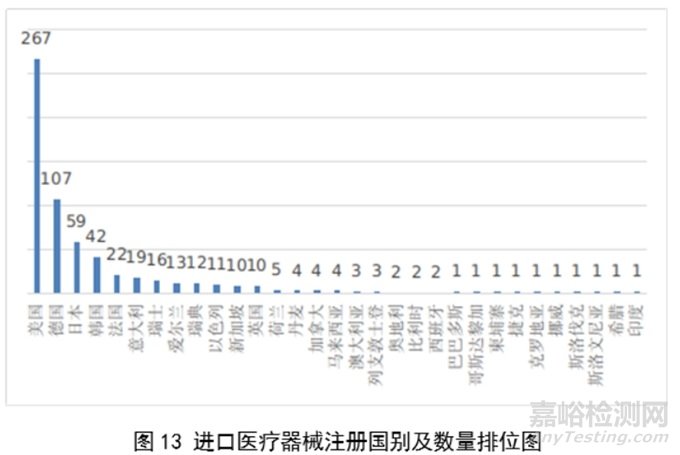
其中,美国、德国、日本、韩国、法国医疗器械在中国医疗器械进口产品首次注册数量位列前5位,注册产品数量约占2023年进口产品首次注册总数量的77%,与2022年相比略有增加。
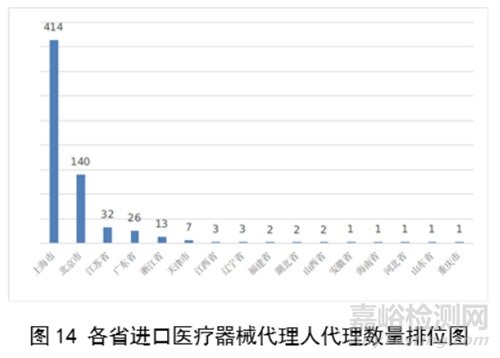
从进口医疗器械代理人分布看,共有16个省涉及有本省企业作为进口医疗器械代理人,其中上海市的进口医疗器械代理人代理的进口医疗器械首次数量最多,占全部进口医疗器械首次注册数量的64%。
(六)境内第三类医疗器械首次注册省份分析
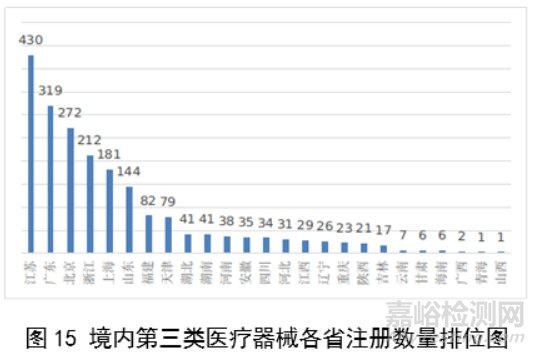
从2023年境内第三类医疗器械首次注册情况看,相关注册人主要集中在沿海经济较发达省份。青海首次有境内第三类医疗器械获准注册。
其中,江苏、广东、北京、浙江、上海是境内第三类医疗器械首次注册数量排前五名的省份,占2023年境内第三类医疗器械首次注册数量的68%,但与2022年相比略有减少。
四、创新医疗器械等产品注册审批情况
2023年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请466项,比2022年增加35.9%,其中69项获准进入创新医疗器械特别审查程序。
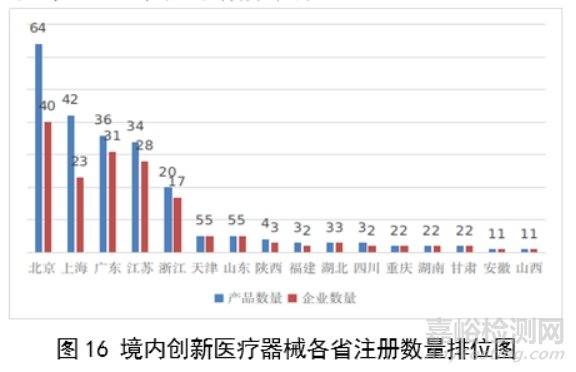
从2014年至2023年,国家药监局共批准250个创新医疗器械。其中,境内创新医疗器械涉及16个省的167家企业,进口创新医疗器械涉及5个国家的18个企业。
北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的250个创新医疗器械的78.4%,但与2022年相比有所下降。
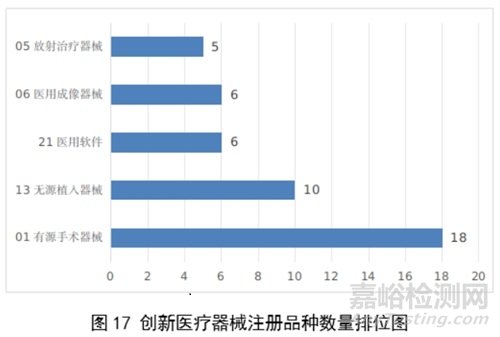
2023年,国家药监局共批准61个创新医疗器械产品上市,相比2022年增加11%。其中有源医疗器械43个,无源医疗器械16个,体外诊断试剂2个。有源手术器械、无源植入器械、医用软件、医用成像器械、放射治疗器械等高端医疗器械是2023年批准的创新医疗器械数量前五位。具体见图17。
这些创新产品核心技术都有我国的发明专利权或者发明专利申请已经国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。以下是已批准创新医疗器械产品介绍:
(一)病人监护仪:该产品由主机、插件模块和附件组成。可对患者进行心电(含ST段测量及心律失常分析)、阻抗呼吸、体温、脉搏血氧饱和度、脉率、无创血压、有创血压、呼吸及呼吸末二氧化碳、麻醉气体、无创心输出量(仅适用于成人患者)、有创心输出量(仅适用于成人患者)监护,同时具有心电图、PICC、呼吸氧合图、肾功能计算、血液动力学计算、氧合计算、通气计算、药物计算、记录仪功能。该产品预期在医疗机构由经培训合格的专业临床医生和护士使用,其应用领域包括手术室、ICU和普通科室。
该产品采用了心电信号自适应滤波技术和四电极心电系统技术,可通过实时观察腔内心电图P波的变化,反馈导管末端位置,实现置管操作过程中对导管末端的实时定位。与传统中心静脉置管术方法相比,该产品具有中心静脉置管末端定位功能,有助于提高PICC导管到位率。
(二)混合闭环胰岛素输注系统:该产品由胰岛素泵套件、发送器套件和葡萄糖传感器组成,具有两项主要核心技术:一是自动模式使用的混合闭环算法;二是用于检查传感器状态的电化学阻抗谱技术,该技术可确保葡萄糖传感器有充分的准确度。该产品通过人体佩戴的葡萄糖传感器对皮下组织间液的葡萄糖浓度趋势持续监测,根据接收的动态葡萄糖监测水平,混合闭环胰岛素泵可持续向14岁及以上Ⅰ型糖尿病患者体内输注基础量胰岛素(用户可选速率)与胰岛素大剂量输注(用户可选剂量),通过安全防护技术,可根据持续葡萄糖监测情况自动调整基础率胰岛素的输注,确保全天候的血糖可控,便利糖尿病患者的生活。
(三)血液透析尿素清除率计算软件:该产品是具有自主知识产权的国内首创产品,性能指标达到国际先进水平。临床用于维持性血液透析成年患者的血液透析尿素清除率计算,不适用于残肾功能计算。尿素清除率是衡量血液透析充分性的重要指标。目前主要采用有创方式取血法进行计算,存在操作繁琐、无法连续计算等问题,可能导致患者出现贫血。与取血法相比,该产品可结合患者已有指标和血液透析治疗参数计算尿素清除率,依据局部尿素动力学模型计算患者模拟体液量,具有无创、操作简单、可连续计算等优势,能够及时调整透析方案,有效提高患者透析效果。
(四)胶原蛋白软骨修复支架:该产品在生产中创新性地采用了胶原提取的过程除菌工艺,并去除了具有免疫原性的端肽结构,能够批量化、稳定地生产出具有完整三螺旋结构的胶原蛋白材料。该产品以胶原蛋白为主要成分,将其作为生物支架为自体骨髓间充质干细胞(BMSCs)提供细胞粘附、增殖、迁移的空间。胶原蛋白软骨修复支架植入后,其中的软骨细胞由BMSCs分化以及周围健康软骨组织中迁移并增殖。软骨细胞不断合成分泌II型胶原蛋白,形成新的软骨组织,进而修复缺损软骨。在此过程中,胶原蛋白支架逐步降解,降解产物可被软骨细胞作为营养物质吸收,也可经过代谢排出体外。现有的软骨损伤修复技术常见包括微骨折术、软骨移植、软骨细胞移植以及关节置换等。胶原蛋白软骨修复支架配合膝关节微骨折术使用,产品的上市预期让更多的患者受益。
(五)磁共振监测半导体激光治疗设备:该产品的磁共振监测核心技术具有国家发明专利,在激光治疗过程中,通过磁共振温度成像技术,实时接收磁共振设备的梯度回波序列,从而计算治疗区域温度,对治疗过程实时监控。该产品与一次性使用激光光纤套件配合,用于对药物难治性癫痫患者(有明确的致痫区部位或明确的癫痫传导途径)的局部病灶进行激光治疗且治疗时间短,对健康脑组织损伤小,术后并发症少,患者恢复快,降低了神经外科颅内病灶的治疗难度。
(六)冠状动脉CT血流储备分数计算软件:该产品基于冠脉CT血管造影图像计算获得CT血流储备分数,用于辅助评估稳定性冠心病患者的功能性心肌缺血状态,可以帮助临床医生判断冠脉狭窄是否引起心肌缺血,确定患者是否需要进一步进行介入检查和治疗。作为传统影像学检查的补充,相应软件的上市,将有助于进一步减少患者诊断时间和支出负担。
(七)一次性使用激光光纤套件:该产品的材料、结构和制作工艺等核心技术具有国家发明专利。在长时间工作状态下,光纤受热几乎不发生形变,沿其轴向散射出的激光强度能够保持相对一致,不仅可以增加治疗范围,同时也可降低激光功率密度,有效提高了使用安全性。该产品与磁共振监测半导体激光治疗设备配合使用,实现了神经外科颅内病灶的全微创治疗,用于对药物难治性癫痫患者(有明确的致痫区部位或明确的癫痫传导途径)的局部病灶进行激光治疗。治疗时间短,对健康脑组织损伤小,术后并发症少,患者恢复快,降低了神经外科颅内病灶的治疗难度。
(八)人工晶状体:该产品为一件式后房人工晶状体,采用专利波前塑形技术,可较为充分地利用进入眼内的光线,同时预期将改善衍射型人工晶状体普遍存在的光晕和/或其他视觉干扰的副反应。该产品适用于术前角膜散光<1.00D且经囊外白内障摘除术摘除白内障晶状体后无晶状体眼的成人患者,一期植入人工晶状体进行视力矫正。该产品通过扩展焦深来减轻老视对患者近视力、中视力及远视力的影响,在保持相当远视力的前提下,扩展从远距离至功能性近距离的视力范围,降低患者对眼镜的依赖。产品的上市将为患者带来新的治疗选择。
(九)冠状动脉功能测量系统:该产品由工作站、传感器支架、IBP导联线、IBP信号输入电缆(选配)组成,仅限与该公司的一次性使用有创压力传感器配合使用。该产品通过对冠状动脉造影影像进行血管分割、三维重建,获取血流速度,结合有创压力传感器测量的主动脉压进行血流动力学分析,实现对冠状动脉造影微循环阻力指数(caIMR)的评估,辅助临床医生评价患者冠状动脉微循环功能情况。
(十)金属增材制造胸腰椎融合匹配式假体系统:该产品包括胸腰椎融合匹配式假体,以及配合组件钉扣、螺钉。该产品创新性采用聚乙烯钉扣作为柔性连接装置,联合后路钉棒系统,实现前后路联合固定的“桁架”结构。对于需进行多节段胸腰椎切除重建的患者人群,该产品采用多孔结构,同时可实现患者匹配设计(基于患者CT数据设计制造)和植入假体固定,可在一定程度提高患者术后生活质量和患者生存率。该产品适用于上胸椎至下腰椎(T1-L5)因肿瘤或其它病变需行连续三个及以上节段椎体切除后的结构重建,需与脊柱内固定系统匹配并实现永久植入。产品的上市将为患者治疗提供新的选择。
(十一)肠息肉电子下消化道内窥镜图像辅助检测软件:该产品在医疗机构供执业内窥镜医师用于成人结肠内窥镜检查时,在内窥镜图像处理器输出的独立视频图像中实时显示疑似息肉的区域。该产品为国内首个利用深度学习技术同时进行结直肠镜检查质量控制和息肉辅助检测的软件。该产品与现有国内外已上市同类产品相比,在识别息肉的同时,采用深度学习技术、感知哈希算法等技术辅助医生进行操作控制,进一步确保肠镜检查质量,减少漏检率,并提升检查操作的规范性。
(十二)血管内成像设备与一次性使用血管内成像导管:两个产品配合使用,用于经皮冠状动脉介入手术时对冠状动脉进行血管内成像。该产品成像导管远端安装有声学探头与光学探头,能自动获取图像并反馈至图像处理模块,实现同步配准的血管内超声和光学干涉断层成像。该产品优于同类已上市产品,能够同时实现上述两种成像,同步满足医生对分辨力和穿透力的要求,简化了医生操作,提高了成像的准确性和安全性。
(十三)放射治疗计划软件:该产品适用于制定光子束和电子线的外照射放疗计划。其核心技术主要包括自动布野技术和自动计划优化技术,前者根据患者体位、靶区位置和投影形状等信息,自动设计机架射束角度和准直器角度;后者通过预设的方案自动调整相关优化目标,使得最终计划的各项要求达到处方要求。与现有放射治疗计划软件相比,可减少人工操作步骤,降低用户工作强度,减轻对用户操作经验的依赖。
(十四)冠状动脉介入手术控制系统及其一次性使用附件:冠状动脉介入手术控制系统和一次性使用冠状动脉介入手术控制系统附件配套使用,辅助临床医生在经皮冠状动脉介入手术期间,输送和操作导丝、导引导管或者快速交换球囊扩张导管/支架。与传统冠状动脉介入手术方式相比,医生在屏蔽环境下通过该产品的操作控制台,驱动机械臂及其末端安装的配套附件,实现对介入器械的操控,减少了医生在手术中的射线暴露,并且该产品可实现量化的血管尺寸测量,辅助医生判断病变长度。
(十五)结肠息肉电子内窥镜图像辅助检测软件:该产品用于成人结肠息肉检查,可在电子内窥镜设备输出视频图像中显示疑似息肉区域。其原理是在电子内窥镜图像处理器输出的视频流中导入视频图像信号,经过软件深度学习算法分析后将疑似息肉位置进行标记,并在视频客户端显示,电子内窥镜原始图像显示不受影响。医生结合患者病情,根据电子内窥镜标记图像,研判是否存在息肉。
(十六)碳离子治疗系统:该产品为我国第二款具有自主知识产权的国产碳离子治疗系统,性能指标达到国际水平。该产品的获批,标志着我国高端医疗器械国产化又迈出重要一步,对于提升我国医学肿瘤诊疗手段和水平,具有重大意义。该产品包含4个治疗室,与此前已批准国产碳离子产品相比,增加45度和90度2个治疗室,缩小调制扫描治疗头束斑尺寸,提升束流强度,缩短束流关断时间,配置图像引导系统,升级患者支撑装置,提升了治疗的效率和安全性。该产品获批上市后,将进一步提升治疗水平,降低治疗成本,满足恶性实体肿瘤患者治疗需要。使用者应当严格按照产品批准的适用范围使用产品,同时应当严格遵守卫生健康部门的诊疗规范。
(十七)植入式左心室辅助系统:该产品由植入部件、体外部件、手术附件组成,与特定人工血管配套使用,为进展期难治性左心衰患者血液循环提供机械支持,用于心脏移植前或恢复心脏功能的过渡治疗。该产品为第三代非接触式磁悬浮离心泵,核心技术主要为盘式电机技术,其利用位置传感器检测并控制转子的转速和悬浮高度。该产品电机仅采用一组定子线圈同时控制转子的旋转和悬浮,结构更简单、重量更轻、体积更小、功耗更低,在临床应用中,手术切口较小,患者恢复较快,适用人群更广,并可降低血泵热量导致的血栓风险。
(十八)多模态肿瘤治疗系统:该产品是集液氮冷冻与射频加热于一体的多模态治疗系统,通过对目标病灶预冷冻,后续进行射频加热并对过程精确控制,从而实现加热区域与冷冻区域重合的多模态肿瘤消融,达到病灶精准治疗效果。该产品通过对消融针设计优化,有效克服气阻问题,实现高效相变换热。在消融针治疗段通过屏蔽射频干扰,实现治疗过程中肿瘤组织精准测量与实时反馈。在消融针非治疗段采用高真空工艺技术,构建超薄真空绝热层,实现射频电磁场屏蔽,在完全消融肿瘤的同时,最大程度避免周围组织的损伤。一体化控制系统通过对预冷冻和射频加热过程的精准控制,还可实现消融区域的可视化。
(十九)植入式骶神经刺激系统:该产品由“植入式骶神经刺激器”、“植入式骶神经刺激延伸导线”、“植入式骶神经刺激电极”三个产品配套使用,构成植入式骶神经刺激系统,其核心技术具有自主知识产权。该系统通过六触点骶神经刺激输出,可产生多路刺激脉冲信号,利用远场程控通信技术可实现非近距离接触下刺激器参数调控。而且,该系统结合六触点电极可提供更多刺激组合,调控范围更加精细,并增加了下尿路功能障碍治疗方法,进一步满足患者临床需要。
(二十)穿刺手术导航定位系统:该产品将导航配准、机械臂定位、呼吸追踪集成为胸腹部穿刺导航定位系统,为国内首创。与常规CT引导方式相比,该产品可以提高成人肺及腹部实体器官穿刺手术的一次到位率,减少进针次数和CT扫描次数,具有显著临床应用价值。
(二十一)锆铌合金股骨头:锆铌合金股骨头与该企业同系列髋关节假体组件配合使用,适用于全髋关节假体置换。该产品采用符合国际标准(ASTM F2384)的锆铌合金,经表面梯度氧化形成类陶瓷层,可以减少高交联聚乙烯髋臼内衬磨损,降低髋关节假体翻修率。与目前临床常用类似预期用途的钴铬合金股骨头产品相比,该产品可减少金属离子析出、降低关节面磨损;与陶瓷股骨头产品相比,可降低假体碎裂、关节异响等风险。该产品上市将为临床治疗提供更多选择。
(二十二)腹腔内窥镜单孔手术系统:该产品由医生控制台、患者手术平台、三维电子腹腔内窥镜、手术器械及附件组成,用于泌尿外科腹腔镜手术操作,为国内首个内窥镜单孔手术系统,有效填补了国内空白。该产品中的手术器械采用国际首创、拥有自主知识产权的创新技术,具有运动范围广、负载能力强和可靠性高等技术优势。该产品以单孔方式实施手术,减少患者腹部开孔数量。内窥镜及手术器械有多个主动自由度,仅通过手术器械在患者腹腔内的运动即可完成手术操作。体外定位臂在遥操作过程中保持静止,避免了术中相互碰撞的风险。医生利用该产品特有操控系统进行控制,可提高操作精细化水平,减少手术创伤。
(二十三)头颈部X射线立体定向放射外科治疗系统:该产品由3MV医用直线加速器、倾斜轴和垂直轴机架、X射线高压发生器、X射线管组件、X射线探测器、治疗床、空压机、主电源、副电源、水冷系统、悬吊式控制台、操作者控制台、治疗计划软件组成,用于颅内和颈部实体恶性肿瘤和病变的放射治疗。该产品的自屏蔽结构设计将辐射水平限制在可接受的安全阈值范围内,不需建设防护墙,降低了医院机房建设成本,加快了产品安装周期。钨轮准直器和优化的直线加速器进一步提高了剂量准确性,实现辐射束半影最小化,确保更多辐射剂量到达肿瘤区域,减少对肿瘤周围正常组织的辐射,具有一定临床优势。
(二十四)膝关节置换手术导航定位系统:该产品由主机、主控台车、导航定位工具包组成,在成人全膝关节置换手术过程中,应用六自由度机械臂辅助医生完成膝关节假体安装等工作,为国内首创。该产品与传统人工全膝关节置换术相比,可以保证手术定位精度,减轻不良事件和并发症的发生概率,降低X射线对医生和患者的辐射损伤。
(二十五)人工晶状体:该产品为一件式后房人工晶状体,其前表面中心采用具有专利技术的波前塑形结构。该产品适用于存在角膜散光且经囊外白内障摘除术摘除白内障晶状体后的成人患者,一期植入该产品通过扩展焦点深度进行视力矫正,即在保持相当远视力的前提下,扩展从远距离至功能性近距离的视力范围,降低患者对眼镜的依赖。该产品上市将为临床治疗提供更多选择。
(二十六)静脉支架系统:静脉支架系统由自膨式镍钛合金支架和输送系统组成。自膨支架由镍钛丝编织而成,具有柔顺性、抗折性和耐疲劳性。该产品带有独特的释放自补偿结构,保证在手术过程中静脉支架释放形态稳定精准;还具有可回收功能,可在静脉支架没有被完全推出输送系统的情况下,将90%支架长度重新回收至输送系统内,并重新定位释放一次,解决释放中的异常问题,提高产品安全性。该产品预期在髂股静脉内使用,用于治疗非血栓性髂静脉压迫综合征和深静脉血栓形成后综合征。该产品上市将为临床治疗提供更多选择。
(二十七)冲击波治疗仪:产品由主机(含冲击波源、水处理装置、定位架、台车)、治疗头(含水囊)、脚踏开关(选配)组成。该产品在医疗机构中使用,用于对轻中度血管性勃起功能障碍的辅助治疗。
(二十八)医用电子直线加速器:该产品由机架、束流产生模块、射野成形模块、治疗床、图像引导系统、控制系统组成,属国内首创,用于对人体适合接受放射治疗的实体肿瘤和病变提供图像引导下的三维适形放射治疗、适形调强放射治疗、容积调强放射治疗以及体部立体定向放射治疗。该产品应用带导电滑环的环形机架,对于临床上较复杂的需要多次连续治疗的患者,可缩短治疗时间,提高治疗效率。
(二十九)硬性巩膜接触镜:该产品为日戴型硬性巩膜接触镜,是一种大直径的硬性接触镜(俗称“巩膜镜”),镜片材料为氟硅丙烯酸酯(hexafocon A),着冰蓝色。该产品由光学区(OZ)、中周区(PCCZ)、角膜缘区(LCZ)和巩膜着陆区(SLZ)四个弧段组成,在临床验配时可通过对各弧段进行参数调整获得更理想的镜下液厚度,改善患者视觉质量的同时还可保护角膜组织。该产品创新性采用双矢深非对称设计,能够更好地匹配不对称巩膜;巩膜着陆区为反转弧面设计,患者佩戴体验更舒适。该产品适用于矫正不规则散光,或同时合并有+25.00D至-25.00D,角膜规则散光小于5.00D的屈光不正患者。该产品上市将为临床治疗提供更多选择。
(三十)髋关节置换手术导航定位系统:该产品由机械臂台车、主控操作台车、光学追踪台车、脚踏开关、医用电动骨钻和手术工具组成,与经验证的髋关节假体和手术工具联合使用,可以在髋关节置换手术中辅助医生完成髋臼打磨、股骨截骨、髋关节假体安装等工作。该产品具有自主知识产权,各项性能指标达到国际同品种器械水平。与传统人工髋关节置换术相比,该产品可以提升手术定位精度,减轻不良事件和并发症的发生概率,降低X射线对医生和患者的辐射损伤。
(三十一)磁共振成像系统:该产品由磁体、检查床、谱仪、梯度功率放大器、射频功率放大器、氙射频功率放大器、配电系统、生理信号门控单元等组成,拥有自主知识产权。该产品在常规磁共振成像系统基础上增加氙核成像功能,可使气体无侵入、无辐射地在肺部分布,为我国首款可用于肺部气体成像的磁共振成像系统。
(三十二)颅内取栓支架:该产品由头端、丝网、推送轴、控制丝和手柄组成,与国内外已上市同类产品相比,其可控膨胀技术为国际首创。在手术过程中,医生能实时控制该产品的膨胀程度和施加在血管与血栓上的径向力大小,使其安全输送至病变部位,释放过程更加精准,增加取栓成功率;回撤时,医生也可对该产品进行适度收缩,降低径向力从而减少对敏感脆弱血管壁的扰动和损伤。该产品预期可提高急性缺血性脑卒中患者的术后血管再通率,提高患者生活质量。
(三十三)冷冻消融设备和球囊型冷冻消融导管:两个产品配套使用,用于药物难治性、复发性、症状性的阵发性房颤治疗,属国内首创。其采用目标温度控制技术和多路测温技术,在治疗过程中可控制球囊内部温度,并实现球囊表面温度监测,确保手术更加安全。该产品的上市可进一步满足我国在阵发性房颤治疗领域的临床需求。
(三十四)注射用重组Ⅲ型人源化胶原蛋白溶液:该产品为无色或类白色液体,由重组Ⅲ型人源化胶原蛋白和0.9%的生理盐水组成,适用于面部真皮组织填充以纠正额部动力性皱纹(包括眉间纹、额头纹和鱼尾纹)。该产品采用的重组胶原蛋白生物材料可组装成胶原蛋白纤维网,对细胞、组织起支撑作用,使皱纹塌陷的部位得到物理填充。产品免疫原性风险可控,注射后会逐渐被体内胶原蛋白酶分解吸收。
(三十五)二尖瓣夹系统:该产品由二尖瓣夹、输送系统和跨瓣器组成。其中,输送系统由输送器、推送器、装载器、导管鞘和扩张器组成。使用该产品,在手术中无需心脏停跳和体外循环,创口小,手术入路短,定位直接;且单纯超声引导介入,使得医生和患者不会受到X射线影响。其二尖瓣夹捕获范围较大,有利于操作;采用了闭合环设计,夹臂之间不易分开,保证夹合稳固。该产品采用经心尖手术方式,适用于经专业心脏团队评估后认为存在外科手术高风险,且二尖瓣瓣膜解剖结构适合的退行性二尖瓣反流(MR≥3+)患者。这些患者的基础疾病不应影响降低二尖瓣反流后带来的临床受益。该产品的上市将为临床治疗提供更多选择。
(三十六)非小细胞肺癌组织TMB检测试剂盒(可逆末端终止测序法):该产品用于体外定性检测EGFR基因突变阴性和ALK阴性的非鳞状非小细胞肺癌患者经福尔马林固定的石蜡包埋(FFPE)组织样本中的肿瘤突变负荷(TMB)。肿瘤突变负荷(TMB)是一个免疫检查点抑制剂治疗疗效预测标志物。该产品由我国自主研发并拥有知识产权,通过高通量测序技术检测425个基因,计算肿瘤突变负荷。临床研究数据显示,肿瘤突变负荷高的人群使用抗肿瘤药物卡瑞利珠单抗联合化疗比肿瘤突变负荷低的人群可显著延长无进展生存期。
(三十七)X射线计算机体层摄影设备:该产品由扫描架、高压发生器、X射线球管以及X射线管组件、限束器、光子计数探测器、电源分配单元、患者支架、激光器、控制台、图像处理软件、控制主机、重建工作站组成,用于常规CT检查,支持冠状动脉CT血管造影和能谱检查。该产品采用光子计数探测器创新技术,能够计算入射的X射线光子数量并测量光子的能级。与使用传统能量积分探测器的CT相比,该产品的空间分辨率更高,能够直接获取能谱图像,可以进一步满足临床影像诊断需求。
(三十八)关节置换手术模拟软件:该产品由扫描安装程序和授权文件组成。软件包括6个功能模块:用户管理模块、三维重建显像模块、基于深度学习的骨骼分割模块、骨骼髓腔中心线提取模块、基于深度学习的识别和测量模块、假体模板匹配模块。该产品采用国内首创的深度学习技术,对符合格式的CT图像进行三维重建、分割,自动识别解剖位点,辅助医生进行成人髋关节、全膝关节置换手术模拟。该产品上市预期可提高人工关节安放的精准性,减少术后并发症。
(三十九)质子治疗系统:该产品由加速器子系统和治疗子系统组成。加速器子系统包括主加速器系统、能量选择系统和射束传输系统,治疗子系统含3个治疗室,包括360度旋转束治疗系统和治疗计划系统。该产品提供质子束进行放射治疗,适用于治疗全身实体恶性肿瘤及三叉神经痛等良性疾病,具体适应症由临床医师根据实际情况确定。该产品是首台获批的采用超导回旋加速器技术和360度旋转机架的质子治疗系统。上述技术确保了产品结构紧凑,并可以实现多角度治疗。同时,该产品在保证患者治疗效果的前提下,能够有效缩短患者治疗时间。
(四十)单光子发射及X射线计算机断层成像系统:该产品由单光子发射计算机断层扫描系统(SPECT)主机(含两个SPECT探测器)、CT主机架、检查床、PDU服务器、采集客户端工作站、SPECT采集服务器工作站、CT采集重建工作站、影像处理工作站、患者定位监视器、SPECT准直器等组成。该产品临床用于肿瘤、心血管系统、泌尿系统、神经系统疾病的影像学检查及评估,其SPECT部分还可单独成像。作为国产首台可变角、双探头、通用型SPECT/CT一体机,该产品不仅填补了国内空白,而且各项性能指标达到国际先进水平,其临床应用可进一步提升我国肿瘤、缺血性心脏病、肾脏疾病的诊断能力,有助于节省临床资源、降低医疗成本。
(四十一)增材制造聚醚醚酮颅骨缺损修复假体:该产品基于患者颅骨缺损的影像学数据,创新性采用聚醚醚酮医用粉料,经选择性激光烧结增材制造加工而成,能够匹配患者缺损部位,通过三维嵌入方式实现颅骨缺损替代,恢复患者原颅骨曲率实现缺损区三维重建。该产品适用于颅骨缺损修复重建的外科治疗。其利用增材制造技术可打印更多复杂的颅颌骨形态,同时颅骨缺损修复假体的打印纹理对头皮无机械切削作用,无假体穿出风险。此外,该产品还解决了聚醚醚酮粉末在选择性激光烧结成形中的回收问题,在同等临床效果基础上,提高材料利用率,降低生产成本。产品上市将为患者治疗提供新选择。
(四十二)增材制造匹配式人工膝关节假体:该产品包含股骨髁假体、胫骨托假体、半月板假体。股骨髁假体和胫骨托假体由钴铬钼粉材经激光增材制造而成,半月板假体由超高分子量聚乙烯材料制成。该产品采用全膝关节假体的个性化设计,其关节曲面仿生设计能够重建正常股髌关节运动功能。该产品与骨水泥配合使用,适用于膝关节假体置换,骨关节炎患者和特殊患者均可使用。产品能够在各截骨面上实现良好覆盖,有效解决了不匹配和过覆盖问题。产品的上市将为患者治疗提供新的选择。
(四十三)腹腔内窥镜单孔手术系统:该产品由医生控制台、患者手术平台、图像处理机、三维电子腹腔内窥镜、手术器械和附件组成。基于单孔手术方式的腹腔内窥镜手术系统,设计了多自由度具有肩肘-腕柔性铰链关节的手术器械,实现操作灵活精准性和较大负载能力,在以单孔方式实施腹腔镜手术时,由于内窥镜及手术器械具有多个主动自由度,仅依靠手术器械在患者腹腔内的运动即可完成手术操作,而体外定位臂在遥操作过程中保持静止,避免了术中相互碰撞风险,可提高手术操作精细化水平,减少患者腹部开孔数量、减少手术创伤。
(四十四)一次性使用心腔内超声诊断导管:该产品由导管主体、操作手柄和连接器组成,配合该公司生产的便携式彩色超声诊断仪,适用于医疗机构开展心脏及心脏大血管、心内解剖结构的超声成像。该产品通过高频超声波对心脏部位进行二维成像和三维建模,能够准确、快速、高效地实现超声手术。该产品可提供实时精确的解剖图像,同时监测血流动力学变化,对于心脏组织特征及细微结构的显示较好,能够实时监测,及时发现与手术相关的并发症,最大限度保障手术安全。该产品的上市有利于降低临床治疗费用,使更多患者受益。
(四十五)明胶-聚己内酯分层牙龈修复膜:该产品为白色膜状,纤维层结构,是由明胶和聚己内酯经静电纺丝技术制成的三层复合膜,上下两层为明胶,中间层为聚己内酯,不区分正反面。其中,明胶纤维层与创面接触,协助角化龈增宽;聚己内酯纤维层为复合膜增加机械强度,方便操作及取出,不与人体组织直接接触。该产品适用于口腔角化龈增宽,加深前庭沟,可根据适用部位预期修复面积大小选择合适型号。产品的上市将为患者治疗提供新的选择。
(四十六)经导管二尖瓣夹系统:该产品由导引鞘、二尖瓣夹系统两个部件组成。其中,二尖瓣夹系统包含二尖瓣夹和输送系统,其二尖瓣夹的弹性中心封堵网结构,可以增加夹合密封性,降低中心残余反流,降低瓣叶夹合力;同时,二尖瓣夹还具有单独捕获瓣叶、重复定位抓捕等功能设计,可以提高操作精度,减少二尖瓣夹脱落及瓣叶穿孔的风险。该产品适用于经心脏团队评估后,认为存在外科手术高风险,且二尖瓣瓣膜解剖结构适合的退行性二尖瓣反流(MR≥3+)患者。该产品的上市将为临床治疗提供更多的选择。
(四十七)冷冻消融设备和球囊型冷冻消融导管:“冷冻消融设备”由冷冻装置、真空系统、低温工质输送回路和控制系统组成。“球囊型冷冻消融导管”由设备连接部件、操作控制部件和血液接触部件组成。上述两个产品在医疗机构配套使用,用于药物难治性、复发性、症状性、阵发性房颤的治疗。治疗过程中,“冷冻消融设备”可将氮气经热交换器冷却后输送至球囊内腔,使与组织接触的球囊产生低温,并通过导管反馈的温度,动态调控冷冻介质的压力和流量,将球囊表面温度维持在规定范围内。同时,该设备真空泵持续抽取导管外层管路内的空气,使产品外层管路达到高真空的隔热状态,确保非消融区域的安全,提高了手术安全性。
(四十八)骨盆骨折复位手术导航定位系统:该产品由主控台车、机械臂台车、导航定位工具组成,用于成人骨盆骨折手术中骨折复位,以及手术过程中手术工具、骨针及螺钉植入物的导航定位。该产品基于术前CT与术中CBCT影像配准、镜像与曲面连续性约束、力—位置双重反馈控制等技术,实现术中骨块及工具三维实时导航、骨盆骨折闭合复位手术规划建议、机器人复位操作控制等功能。该产品是国内首个采用机器人技术实现骨盆骨折闭合复位的手术导航定位系统,与传统手术相比,可提高闭合复位的成功率,降低开放手术风险,缩短恢复时间和住院时间,同时减少患者、医护辐射暴露剂量。
(四十九)可降解镁金属闭合夹:该产品由可降解镁金属闭合夹和基座组成。镁金属闭合夹包括上臂、下臂和尾部O型结构三部分,放置于基座内。其中,可降解镁金属闭合夹由高纯镁材料制成,可避免现有镁合金产品中常用的铝、稀土等元素对人体健康的潜在风险,且植入后不影响术后X光、CT、核磁等影像学诊断;通过塑性变形和热处理技术调控,增强高纯镁金属的力学性能,提高了闭合夹的稳定性和可靠性。该产品适用于外科手术不需要提供永久闭合力的血管或胆管等管状组织的结扎和闭合,不适用于大动脉和大静脉。该产品的上市将为临床治疗提供更多的选择。
(五十)人乳腺癌分子分型检测试剂盒(PCR-荧光探针法):该产品由检测体系混合液、酶混合液、阳性对照、阴性对照组成,用于体外半定量检测浸润性乳腺癌FFPE组织切片样本中基因ERBB2(HER2)、ESR1(ER)、PGR(PR)以及MKI67(Ki-67)的mRNA表达水平。该产品通过逆转录实时定量PCR(RT-qPCR),利用Taqman技术对四个目标基因(ERBB2、ESR1、PGR以及MKI67)及两个参考基因的mRNA表达水平进行定量检测。对传统免疫组化分析不易判定的情况,以及传统免疫组化分析结果与治疗预期有较大差别的病例样本可提供进一步检测,辅助判断乳腺癌分子分型,提高分型准确性,从而协助医生制定更合理的诊疗方案。
(五十一)一次性使用环形肺动脉射频消融导管:该产品由射频段、连接段、可弯段、主鞘管、色标、控制手柄和连接器组成,是由中国在全球率先批准的通过破坏交感神经治疗肺动脉高压的产品,为肺动脉高压患者提供了新的治疗方式选择,将使更多肺动脉高压患者受益。该产品采用穿刺介入方式通过血路进入人体,配合该公司生产的肺动脉射频消融仪使用,输送射频能量作用于肺动脉相应靶点,从而破坏交感神经,实现治疗肺动脉高压的效果。该产品适用于药物治疗无效、小于70周岁的特发性肺动脉高压、先天性心脏病相关肺动脉高压和结缔组织病相关肺动脉高压的成人患者的辅助治疗。
(五十二)一次性使用心脏脉冲电场消融导管和心脏脉冲电场消融仪:一次性使用心脏脉冲电场消融导管由导管和连接电缆组成,心脏脉冲电场消融仪由主机、输出盒和附件组成,这是国内首个心脏脉冲电场消融类产品。上述两个产品配套使用,通过控制、释放适当强度的脉冲电场能量,有选择性地对需要治疗的病灶部位的心肌细胞产生不可逆的电穿孔损伤,从而达到治疗房颤的目的,为药物难治性、复发性、症状性、阵发性房颤的治疗提供了更多选择。
(五十三)自膨式可载粒子胆道支架:该产品由内、外支架组成,各带有一个一次性使用置入器,外支架带有粒子囊(不含粒子)。该产品将放射性粒子与支架技术结合运用于胆道恶性梗阻治疗,采用内、外双支架结构设计,降低置入器的外管直径,实现微创介入治疗,在扩张支架的同时为三维立体空腔脏器内放射治疗提供载体。该产品适用于因恶性肿瘤导致的无法手术或者不愿手术切除的胆道狭窄/梗阻的扩张及治疗。自膨式可载粒子胆道支架植入后,能起到扩张胆道狭窄的作用,支架上携带的放射粒子对肿瘤组织进行近距离放射治疗,抑制肿瘤生长,预期延长胆管有效通畅时间,提高患者生存时间和生活质量。产品的上市将为患者治疗提供新的选择。
五、其他注册管理情况
(一)境内第二类医疗器械注册审批情况
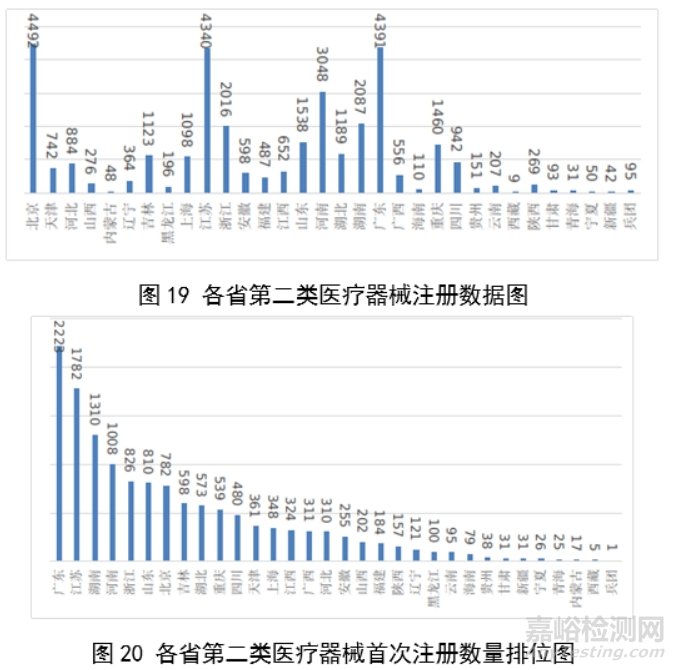
2023年,各省级药品监管部门共批准境内第二类医疗器械注册33584项,与2022年相比增加2.1%。其中,首次注册13952项,与2022年相比增加4.6%。首次注册项目占全部境内第二类医疗器械注册数量的41.5%。延续注册9437项,与2022年相比减少11.3%,占全部境内第二类医疗器械注册数量的28.1%;变更注册10195项,与2022年相比增加14.3%,占全部境内第二类医疗器械注册数量的30.4%。境内第二类医疗器械注册形式及数量情况见图18。
从注册情况看,广东、江苏、北京、湖南、河南、浙江、山东、重庆、上海、湖北10省(直辖市)办理境内第二类医疗器械注册事项较多。
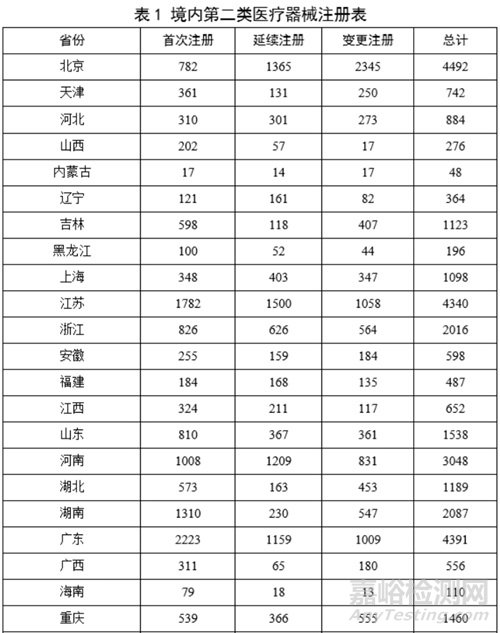
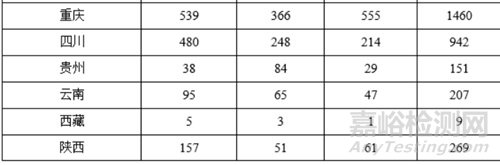
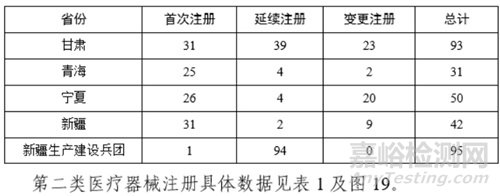
从首次注册情况看,广东、江苏、湖南、河南、浙江、山东、北京、吉林、湖北、重庆10省(区、市)首次注册的境内第二类医疗器械数量较多。各省第二类医疗器械首次注册数量排位见图20。
(二)第一类医疗器械备案情况
2023年,国家药监局依职责共办理进口第一类医疗器械备案数量2453项,与2022年相比增加21.2%。
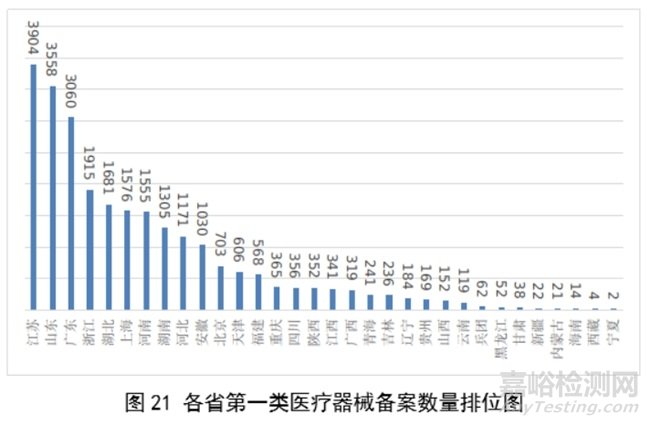
全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量25681项,与2022年相比减少9.9%。此外,2023年各省取消第一类医疗器械备案9876项。其中江苏、山东、广东、浙江、湖北是第一类备案数量前五的省份。各省第一类医疗器械备案数量排位见图21。
(三)变更备案情况
2023年,国家药监局依职责共办理进口第二、三类和境内第三类医疗器械变更备案6352项,与2022年相比增加17.8%。
其中,境内第三类医疗器械变更备案4443项,进口第二类、三类医疗器械变更备案1909项。
各省级药品监管部门依职责共办理境内第二类医疗器械变更备案15583项,与2022年相比增加33.9%。
(四)医疗器械临床试验机构备案情况
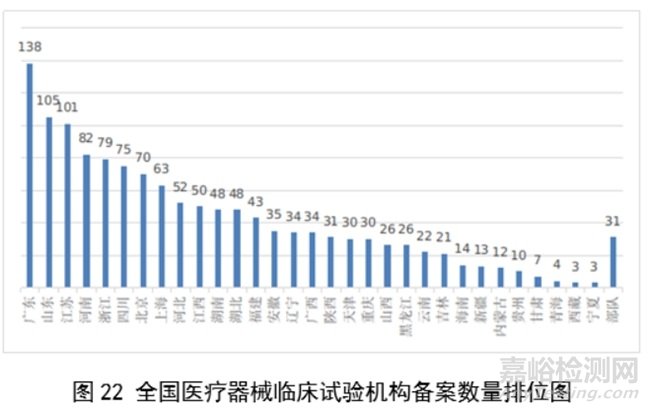
自2018年1月1日《医疗器械临床试验机构条件和备案管理办法》颁布实施以来,全国共计1340个机构完成了医疗器械临床试验机构备案工作,比2022年增加13.8%。
其中广东、山东、江苏、河南、浙江临床试验机构备案数量居全国前五名。全国医疗器械临床试验机构分布情况见图22。
注:本报告的数据统计自2023年1月1日至2023年12月31日。
附件1
2023年获批创新医疗器械产品名单
|
序号
|
产品名称
|
注册人
|
注册证号
|
|
1
|
病人监护仪
|
深圳市科曼医疗设备有限公司
|
国械注准20233070003
|
|
2
|
混合闭环胰岛素输注系统
|
Medtronic MiniMed
|
国械注进20233140061
|
|
3
|
血液透析尿素清除率计算软件
|
北京英福美信息科技股份有限公司
|
国械注准20233210219
|
|
4
|
胶原蛋白软骨修复支架
|
Ubiosis Co., Ltd
|
国械注进20233130129
|
|
5
|
磁共振监测半导体激光治疗设备
|
华科精准(北京)医疗科技有限公司
|
国械注准20233010449
|
|
6
|
冠状动脉CT血流储备分数计算软件
|
上海博动医疗科技股份有限公司
|
国械注准20233210450
|
|
7
|
一次性使用激光光纤套件
|
华科精准(北京)医疗科技有限公司
|
国械注准20233010485
|
|
8
|
人工晶状体
|
Alcon Laboratories, Incorporated
|
国械注进20233160146
|
|
9
|
冠状动脉功能测量系统
|
苏州润迈德医疗科技有限公司
|
国械注准20233070520
|
|
10
|
金属增材制造胸腰椎融合匹配式假体系统
|
北京爱康宜诚医疗器材有限公司
|
国械注准20233130524
|
|
11
|
自膨式可载粒子胆道支架
|
南京融晟医疗科技有限公司
|
国械注准20233130621
|
|
12
|
肠息肉电子下消化道内窥镜图像辅助检测软件
|
武汉楚精灵医疗科技有限公司
|
国械注准20233210629
|
|
13
|
血管内成像设备
|
Conavi Medical Inc.
|
国械注进20233060200
|
|
14
|
放射治疗计划软件
|
上海联影医疗科技股份有限公司
|
国械注准20233210665
|
|
15
|
结肠息肉电子内窥镜图像辅助检测软件
|
腾讯医疗健康(深圳)有限公司
|
国械注准20233210707
|
|
16
|
一次性使用冠状动脉介入手术控制系统附件
|
Corindus Inc.
|
国械注进20233010226
|
|
17
|
冠状动脉介入手术控制系统
|
Corindus Inc.
|
国械注进20233010225
|
|
18
|
碳离子治疗系统
|
兰州科近泰基新技术有限责任公司
|
国械注准20233050708
|
|
19
|
植入式左心室辅助系统
|
深圳核心医疗科技有限公司
|
国械注准20233120716
|
|
20
|
多模态肿瘤治疗系统
|
上海美杰医疗科技有限公司
|
国械注准20233010773
|
|
21
|
植入式骶神经刺激器
|
杭州承诺医疗科技有限公司
|
国械注准20233120807
|
|
22
|
植入式骶神经刺激延伸导线
|
杭州承诺医疗科技有限公司
|
国械注准20233120808
|
|
23
|
植入式骶神经刺激电极
|
杭州承诺医疗科技有限公司
|
国械注准20233120809
|
|
24
|
穿刺手术导航定位系统
|
真健康(北京)医疗科技有限公司
|
国械注准20233010810
|
|
25
|
锆铌合金股骨头
|
苏州微创关节医疗科技有限公司
|
国械注准20233130813
|
|
26
|
冲击波治疗仪
|
深圳市慧康精密仪器有限公司
|
国械注准20233090834
|
|
27
|
腹腔内窥镜单孔手术系统
|
北京术锐机器人股份有限公司
|
国械注准20233010833
|
|
28
|
头颈部X射线立体定向放射外科治疗系统
|
睿谱外科系统股份有限公司
|
国械注进20233050263
|
|
29
|
膝关节置换手术导航定位系统
|
北京天智航医疗科技股份有限公司
|
国械注准20233010962
|
|
30
|
人工晶状体
|
Alcon Laboratories, Incorporated
|
国械注进20233160317
|
|
31
|
静脉支架系统
|
苏州茵络医疗器械有限公司
|
国械注准20233131034
|
|
32
|
医用电子直线加速器
|
西安大医集团股份有限公司
|
国械注准20233051067
|
|
33
|
一次性使用血管内成像导管
|
Conavi Medical Inc.
|
国械注进20233060333
|
|
34
|
硬性巩膜接触镜
|
上海艾康特医疗科技有限公司
|
国械注准20233161081
|
|
35
|
髋关节置换手术导航定位系统
|
杭州柳叶刀机器人有限公司
|
国械注准20233011155
|
|
36
|
磁共振成像系统
|
武汉中科极化医疗科技有限公司
|
国械注准20233061160
|
|
37
|
颅内取栓支架
|
Rapid Medical Ltd.
|
国械注进20233030369
|
|
38
|
球囊型冷冻消融导管
|
上海微创电生理医疗科技股份有限公司
|
国械注准
20233011225
|
|
39
|
冷冻消融设备
|
上海微创电生理医疗科技股份有限公司
|
国械注准
20233011226
|
|
40
|
注射用重组Ⅲ型人源化胶原蛋白溶液
|
山西锦波生物医药股份有限公司
|
国械注准20233131245
|
|
41
|
二尖瓣夹系统
|
上海捍宇医疗科技股份有限公司
|
国械注准20233131292
|
|
42
|
非小细胞肺癌组织TMB检测试剂盒
(可逆末端终止测序法)
|
南京世和医疗器械有限公司
|
国械注准20233401452
|
|
43
|
X射线计算机体层摄影设备
|
西门子医疗有限公司
Siemens Healthcare GmbH
|
国械注进20233060455
|
|
44
|
关节置换手术模拟软件
|
北京长木谷医疗科技有限公司
|
国械注准20233211543
|
|
45
|
质子治疗系统
|
瓦里安医疗系统粒子治疗有限公司
|
国械注进20233050480
|
|
46
|
单光子发射及X射线计算机断层成像系统
|
北京永新医疗设备有限公司
|
国械注准20233061628
|
|
47
|
增材制造聚醚醚酮颅骨缺损修复假体
|
西安康拓医疗技术股份有限公司
|
国械注准20233131652
|
|
48
|
增材制造匹配式人工膝关节假体
|
纳通生物科技(北京)有限公司
|
国械注准20233131698
|
|
49
|
腹腔内窥镜单孔手术系统
|
深圳市精锋医疗科技股份有限公司
|
国械注准20233011753
|
|
50
|
一次性使用心腔内超声诊断导管
|
江苏霆升科技有限公司
|
国械注准20233061761
|
|
51
|
明胶-聚己内酯分层牙龈修复膜
|
诺一迈尔(苏州)医学科技有限公司
|
国械注准20233171776
|
|
52
|
经导管二尖瓣夹系统
|
杭州德晋医疗科技有限公司
|
国械注准20233131775
|
|
53
|
冷冻消融设备
|
康沣生物科技(上海)股份有限公司
|
国械注准20233011815
|
|
54
|
球囊型冷冻消融导管
|
康沣生物科技(上海)股份有限公司
|
国械注准20233011816
|
|
55
|
骨盆骨折复位手术导航定位系统
|
北京罗森博特科技有限公司
|
国械注准20233011923
|
|
56
|
可降解镁金属闭合夹
|
苏州奥芮济医疗科技有限公司
|
国械注准20233021931
|
|
57
|
人乳腺癌分子分型检测试剂盒(PCR-荧光探针法)
|
百欧恩泰诊断有限责任公司
|
国械注进20233400600
|
|
58
|
一次性使用环形肺动脉射频消融导管
|
无锡帕母医疗技术有限公司
|
国械注准20233012011
|
|
59
|
一次性使用心脏脉冲电场消融导管
|
四川锦江电子医疗器械科技股份有限公司
|
国械注准20233012053
|
|
60
|
心脏脉冲电场消融仪
|
四川锦江电子医疗器械科技股份有限公司
|
国械注准20233012051
|
|
61
|
质子治疗系统
|
瓦里安医疗系统粒子治疗有限公司
|
国械注进20233050613
|
附件2
2023年获批优先医疗器械产品名单
|
序号
|
产品名称
|
注册人
|
注册证号
|
|
1
|
新型冠状病毒(2019-nCoV)、甲型流感病毒、乙型流感病毒核酸检测试剂盒(荧光PCR法)
|
苏州创澜生物科技有限公司
|
国械注准20233400090
|
|
2
|
新型冠状病毒(2019-nCoV)核酸检测试剂盒(荧光PCR法)
|
苏州天隆生物科技有限公司
|
国械注准20233400091
|
|
3
|
新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)
|
圣湘生物科技股份有限公司
|
国械注准20233400092
|
|
4
|
新型冠状病毒(2019-nCoV)及甲/乙型流感病毒核酸联合检测试剂盒(荧光PCR法)
|
北京京东方知微生物科技有限公司
|
国械注准20233400274
|
|
5
|
新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)
|
深圳市新产业生物医学工程股份有限公司
|
国械注准20233400313
|
|
6
|
新型冠状病毒(2019-nCoV)抗原检测试剂盒(乳胶法)
|
杭州微策生物技术股份有限公司
|
国械注准20233400364
|
|
7
|
新型冠状病毒(2019-nCoV) 抗原检测试剂盒(胶体金法)
|
郑州科蒂亚生物技术有限公司
|
国械注准20233400363
|
|
8
|
人工晶状体
|
河南赛美视生物科技有限公司
|
国械注准20233160742
|
|
9
|
胚胎培养液
|
东蕴医疗科技(上海)有限公司
|
国械注准20233180837
|
|
10
|
肺脏灌注系统
|
瑞典科沃医疗科技有限公司XVIVO Perfusion AB
|
国械注进20233100363
|
|
11
|
一次性使用血液灌流器
|
苏州仝康医疗科技有限公司
|
国械注准20233101449
|
|
12
|
人类免疫缺陷病毒1型(HIV-1)核酸测定试剂盒(PCR-荧光探针法)
|
广州达安基因股份有限公司
|
国械注准20233402071
|