为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),这些年来NMPA连同CDE在简化药品审批程序方面出台了众多政策和措施,其中针对原辅包的主要政策就是推行了原辅包关联审评审批制度,主要包括出台一系列政策文件、建立原辅包登记平台、施行原辅包登记管理、不强求原料药单独审评审批,取消药用辅料和药包材行政审批等。
前期,针对原辅包关联审评审批主题,本人将目光锁定在国内,推出“原辅包关联审评系列文章”,计划从政策变迁及提炼、核心政策对比与分析、登记资料要求解析、关联审评审批制度解析、经验分享与注意事项等方面给大家系统展现原辅包关联审评审批相关政策理论与实践经验。现今,随着工作内容的扩展,我将视野扩展到世界,在原系列文章的基础上进行升级,推出“原辅包注册认证系列文章”,将对包括中国在内的,美国、欧洲、日本、澳大利亚等国家和地区的相关法规制度、认证程序、以及实践经验进行分享和展现,为大家系统掌握相关知识提供参考。
同样,由于本人经验有限,其中不足及有误之处,还请大家多多包涵,多多指正,咱们相互学习,共同提高,在此致以衷心的感谢!
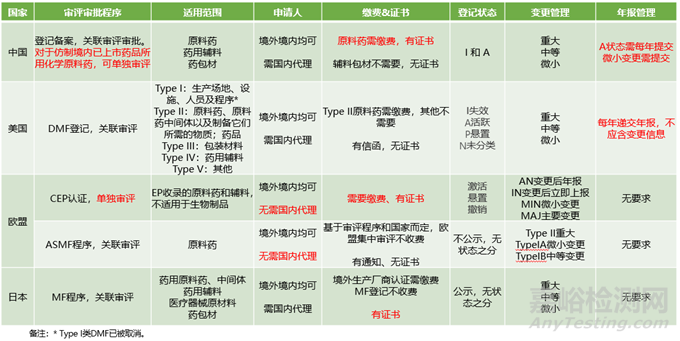
本文我们将通过对一张信息汇总表的解读,一起了解一下全球最重要的四个国家和地区:中国、美国、欧洲、日本,各自在原辅包注册认证方面,执行哪些制度,各个制度之间有哪些区别,以便咱们能在全球视野下,整体了解原辅包注册认证的基本情况。
话不多说,让我们一睹为快,然后我再对各种制度程序进行一一讲解。
一、中国原辅包关联审评审批制度
中国原辅包关联审评的制度,简而言之分为两步:原辅包登记和制剂申报关联审评审批。具体程序分别为:
第一步,原辅包登记人在CDE原辅包登记平台上进行登记,并按要求提交登记资料。CDE审评老师进行形式审查,通过则在登记平台上公示,获得“I”状态;若形式审查有问题,则按要求补正并再次进行形式审查,通过后公示,获得“I”状态。按规定形式审查应在5个工作日完成,但实际执行下来,由于审核工作量等问题,有可能会长一些,一般半个月到1个月之间就能公示。
第二步,使用该原辅包的制剂进行申报时,需取得原辅包登记人提供的授权书,证明制剂研发过程所使用的原辅包是经过相应登记人授权的,而该授权书会作为关联审评审批的线索,让CDE知道在对制剂进行技术审评时,需要关联审评哪个登记号的原辅包。制剂的技术审评需要200+的时间,中间还会涉及注册核查、注册检验,补充研究等流程,耗时较长。审评审批通过,则制剂获得批准通知书,原辅包的登记状态变为“A”状态。
此外,针对一些特殊原因无法进行登记的原辅包,一些仿制境内已上市制剂所用原料药,以及一些特供某一厂家制剂的原辅包,也可通过与制剂资料一并提供研究资料的方法,进行申报和审评审批。
基于以上程序,有几点需要注意:
1)原辅包登记人:既可以是原辅包生产企业,也可以是原辅包供应商,既可以是国内登记人,也可也是国外登记人。其中国外登记人,需由国内代表机构或委托国内代理机构进行登记。无论是何种身份,作为登记人都需要承担一定的法律责任,如保证登记资料真实准确,及时维护登记信息等。其中针对境外登记人,其与其代理机构共同承担上述法律责任。
2)登记状态:以是否通过技术审评审批为分界线进行区分,“I”代表未进行关联审评审批,或尚未通过关联审评审批;“A”状态代表已经通过关联审评审批。另外还有一些满足要求的原辅包,可由CDE自动将其状态转换为“A”,但这类自动转A的原辅包是否能满足最新的法规要求,则还需基于具体关联审评审批而定。
3)原料药与药用辅料、药包材的区别:在中国,原料药至今仍需行政审批,因此针对它,需要进行关联审评和关联审批两个步骤,需要缴费,审批通过后会有批准通知书;相比之下,药用辅料和药包材的行政审批已被取消,只需关联审评一个步骤,无需缴费,也没有相应的批准通知书。
在中国完成登记,以及关联审评审批的原辅包,都可以进行变更。变更类型包括基础信息变更、重大变更、中等变更和微小变更。基础信息变更属于非技术性变更,主要变更一些非技术类的信息,如登记人名称、地址等;而重大、中等和微小变更则为技术类变更,针对变更的风险和影响进行界定,可参考《已上市化学药品药学变更研究技术指导原则(试行)》等相关指导原则进行评估。
此外,原辅包登记完成后,还需要每年第一季度提交上一年的年报,汇总变更情况、关联的制剂产品信息等。此处需要说明一点,年报仅仅是汇总了变更情况,不能作为变更的证明性文件。
二、美国原辅包DMF制度
美国针对原辅包执行DMF登记制度,DMF全称Drug Master File,药品主文件,是关于产品CMC信息(化学、生产、质量控制信息)的一套完整文件资料,作为一种参阅性资料存档在FDA中心档案室(CDR)中。境内外原辅包供应商均可进行DMF登记,其中境外供应商需指定美国代理,而其进行DMF登记的主要目的则是可以在不透露自己保密信息的情况下,被多家制剂企业引用。
美国DMF分为5类,分别为:
Type I:生产场地、设施、人员及程序(2000年07月已被取消)
Type II:原料药、原料药中间体以及制备它们所需的物质;药品
Type III:包装材料
Type IV:药用辅料
Type V:其他
原辅包供应商可基于其产品所属的类型,向FDA提交对应类型的DMF登记。FDA在收到资料和申请后,进行编号备案和行政审评,通过后就直接给予“A”状态,一般历时2~3周。此阶段并不进行技术审评,直到与之关联的药品进行申报时,才与制剂进行关联审评,审评时间基于制剂的不同注册类型而定,以仿制药为例,需要大约10个月的时间。除了仿制药申请引用的Type II类原料药需要缴费之外,其他DMF登记均无需缴费,其缴费原因在于,该类型DMF登记会增加一个历时约60天的完整性审评(即CA审评)阶段,审评通过后进入CA名单。只有进入该名单的原料药,才能被制剂仿制药引用。
这里有两点需要注意,同时也是和中国原辅包关联审评审批程序的两点区别:
1)登记状态的意义:
DMF制度的状态有四种:
A状态:代表处于维护状态,可被引用,但这并不代表已经通过技术审评;
I状态:代表失效状态,多由于未及时维护导致;
P状态:代表悬停状态,比如行政审评中断,技术审评中断时的状态;
N状态:代表未分类状态,多在刚刚进入FDA,尚未进行行政审评时的状态。
中国原辅包登记有2种状态:
A状态:代表通过技术审评,已与制剂完成关联审评审批。
I状态:代表未通过技术审评,比如尚未与制剂关联,或者处于关联审评过程中。
由此可见,DMF的A和I状态,与中国原辅包登记的A和I状态,有着本质区别。
2)关联审评vs关联审评审批
美国DMF程序只有关联审评,不存在批准和不批准之说,不发证书,但会发通知函告知申请人结果。
中国原辅包关联审评审批制度,包括审评和审批两个阶段,其中药用辅料和药包材与DMF相同,只需审评,无需审批,无批准和不批准之说,但原料药却既需要审评,又需要审批,批准则发批准通知书,不批准则发不予批准通知书。
此外,在变更和年报方面,基于变更程度及风险,美国DMF登记变更分为重大、中等及微小变更。类似中国原辅包关联审评审批制度,美国DMF也需要提交年报。
三、欧洲CEP认证制度
欧洲CEP认证,又称COS认证,为欧洲药典适应性认证,适用于被欧洲药典专论收录的原料药和辅料,也就是说如果没有被EP专论收录,无法进行CEP认证。另外,目前生物药不适用于CEP注册程序。
CEP认证的主管部门为欧洲质量监督管理局EDQM。境内外原辅包供应商都可以进行认证,且没有欧洲代理的要求。
CEP认证需要缴费,采用独立审评制,审评通过后颁发CEP证书,基于认证主体可分为化学CEP、植物CEP、TSE产品 CEP,以及组合CEP认证,各类认证时间不同,但均能在欧洲范围内通用,因此常作为原料药和辅料进入欧洲市场的快速通道。基于审评和维护情况,CEP认证目前有激活、悬置和撤销三种状态。
变更方面,基于变更的严重程度分为四种变更类型,分别为AN变更后可在年报中通知,IN变更后立即通知,MIN微小变更和MAJ重要变更。
年报方面,CEP认证不强求进行年报,但有一次五年再注册的要求,再注册后可永久有效。
四、欧洲原料药ASMF登记制度
除了CEP认证之外,欧洲还有一个仅针对欧洲原料药的ASMF登记程序,该程序主管部门为欧洲药品管理局EMA,境内外供应商均可以申请,无代理要求。该程序类似于美国DMF登记程序,相同点是都采用关联审评的方式在制剂申报时一并审评,具体时限基于欧洲不同的申报流程而定;不同点是该登记程序仅针对欧洲上市的原料药,不适用于药用辅料和生物制剂,而且不公示,不区分状态,也不发证书,只发通知函告知登记情况。
变更方面,分为两大类三小类,Type IA为微小变更,Type IB为中等变更,Type II为重大变更。此外,该程序没有年报要求。
五、日本原辅包MF登记制度
在日本,原辅包管理采用MF登记程序,即注册主文件登记程序,该程序的适用范围包括药用原料药,还适用于中间体、药用辅料、医疗器械原材料和药包材等。其主管部门为厚生劳动省下属的PMDA,日本厚生劳动省相当于中国的的NMPA,PMDA相当于中国的CDE。
日本境内外供应商都可以进行登记,但是境外供应商必须指定日本代理,若生产厂在国外,还需要进行国外生产厂确认程序AFM,并获得认定证书和厂商编码BN。MF登记程序本身不收费,但AFM确认程序则需要缴费,并AFM证书需5年更新一次。
其实,日本MF登记程序并非法定必须的程序,而是一种自愿行为。MF登记程序也不存在批准或不批准,MF登记证也不能代表销售证明。递交申请后,PMDA只进行形式审查,通过后发放原料药登记证和登记申请书副本,并在PMDA官网上定期公示登记信息,目前更新频率为每月两次,分别在月中和月底。
日本MF登记程序,采用关联审评制,只有在制剂厂商引用该原料药时才会进行技术审评并实施GMP检查,审评时限基于药物制剂的申报类型而定。
变更和年报方面,MF登记程序分为重大、中等、轻微三类变更,无年报要求。