您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-04-28 13:15
细菌内毒素是注射剂的关键质量属性,注射剂的细菌内毒素不符合标准规定可能导致患者发热、微循环障碍、内毒素休克、播散性血管内凝血等症状,严重时危及患者生命。
基于QbD的研发理念及风险管理措施,为保证药品的安全性及质量可控性,需要科学、合理的制定注射剂的细菌内毒素控制策略,作者通过仿制药注射剂并结合实例深度思考注射剂细菌内毒素的常规控制策略,不当之处还请业内同行予以探讨补充。
1、区分细菌内毒素和热源
(1)细菌内毒素
细菌内毒素: G-菌(革兰氏阴性菌)细胞壁上的特有结构,当细菌死亡或自溶后便会释放出内毒素,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。细菌内毒素的主要化学成分为脂多糖。
(2)热原
热原:由微生物产生的能引起恒温动物体温异常升高的致热物质。它包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等。所以热原有外生致热原和内生致热原之分,致热能力最强的是革兰氏阴性杆菌内毒素。
(3)两者关系
严格地讲,不是每一种热原都具有脂多糖结构,但是所有已知的细菌内毒素都具有脂多糖结构且都有热原活性,所以,一般来说细菌内毒素是热原,但热原不全是内毒素。
在药品研发生产活动中可以接受的是:不存在细菌内毒素意味不存在热原,一般仅会制定细菌内毒素限度,控制内毒素就是控制热原。
2、各国细菌内毒素标准
(1)中国
L=K/M
L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U(活性单位)表示;
K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg∙h)表示,注射剂K=5EU/(kg∙h),放射性药品注射剂K=2.5EU/(kg∙h),鞘内用注射剂K=0.2EU/(kg∙h);
M为人用每千克体重每小时的最大供试品剂量,以ml/(kg∙h)、mg/(kg∙h)或U/(kg∙h)表示,人均体重按60kg计算,人体表面积按1.62m2计算。注射时间若不足1小时,按1小时计算。供试品每平方米体表面积剂量乘以0.027即可转换为每千克体重剂量(M)。
(2)美国
非经肠道药品的内毒素限值,以剂量定义,等于K/M
除了鞘内给药以外的任何给药途径,K均为5 USP-EU/kg,鞘内给药时,K为0.2 USP-EU/kg,对于非鞘内给药放射性药品,内毒素限值的计算为175/V,V为以mL为单位的最大推荐剂量,对于鞘内给药的放射性药品,其内毒素限值为14/V,对于按以每平方体表面积计算的给药剂量(通常是抗肿瘤药品),计算公式为K/M,其中K=5EU/kg;
M为 (最大剂量/m2/小时*1.80m2)/70kg;
由此可知,不同国家药典对于细菌内毒素限度的要求并不完全一致,在仿制药注射剂开发中需保证细菌内毒素的限度不低于参比制剂且符合中国药典标准,在新药注射剂开发中需保证细菌内毒素的限度不低于ICH成员国中最严药典标准(便于国际注册)。
3、仿制药的细菌内毒素控制策略
(1)细菌内毒素限度的选择

参比制剂的细菌内毒素限度小于依据中国药典2020版四部(1143 细菌内毒素检查法)计算的细菌内毒素限度,为保证在仿制药注射剂开发中细菌内毒素的限度不低于参比制剂且符合中国药典标准,所以选择参比制剂细菌内毒素限度作为自研制剂的标准。
(2)细菌内毒素控制策略的理念
按照《化学药品注射剂仿制药质量和疗效一致性评价技术要求》,为了有效控制热原(在药品研发生产活动通常指的是细菌内毒素),需要加强对原辅包、生产过程等的控制。
基于QbD的研发理念,为保证制剂成品细菌内毒素符合限度要求,进而确保药品的安全性及质量可控性,需要对细菌内毒素制定针对性的控制策略:①在源头控制方面,针对原辅包分别制定其细菌内毒素限值;②在过程控制方面,进行生产设备、容器具的除热原控制;③在终点控制方面,在成品中制定细菌内毒素限值;基于全程控制的理念,通过相关的工艺控制及质量控制,为药品制定科学合理的细菌内毒素控制策略。
(3)原辅包细菌内毒素的控制
制剂处方中有原料药、辅料1、辅料2、辅料3(盐酸)、辅料4(氢氧化钠)和注射用水,通过控制原辅料、内包材的细菌内毒素限度,减少原辅料、内包材对制剂成品细菌内毒素的负荷,制剂处方原辅料、内包材的细菌内毒素控制限度如下:
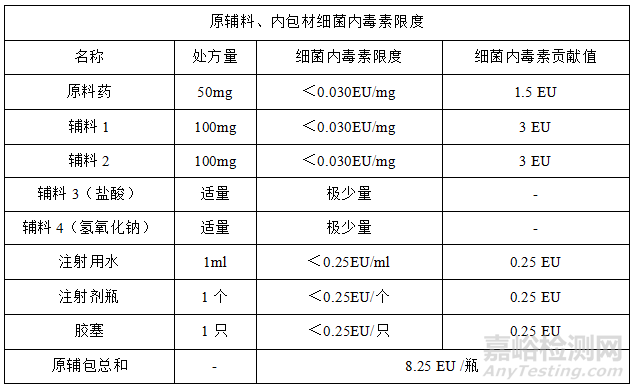
(4)细菌内毒素限度的对比

综上,原辅包细菌内毒素限度总和小于制剂细菌内毒素限度,通过控制原辅料、内包材的细菌内毒素限度,可以减少对制剂细菌内毒素的负荷。
(5)生产设备及容器具的除热原控制
接触药品的生产设备通常会经过碱洗、灭菌及环境控制(密封或层流保护)从而有效的去除热原。
(6)制剂成品中细菌内毒素的控制
为了更好的确保药品的安全性及质量可控性,通常在终点控制方面,在制剂成品中检测细菌内毒素,确保制剂成品细菌内毒素符合标准。
综上,注射剂通过原辅包控制、设备清洁验证、成品检测,来实现制剂全生命周期的细菌内毒素控制策略。
(7)仿制药的内毒素控制策略常出现的问题
①原辅包细菌内毒素过高
原辅包细菌内毒素限度总和大于制剂细菌内毒素限度,使之无法形成有效的细菌内毒素控制策略,通常做法是,根据原辅料细菌内毒素贡献占比,选择贡献占比高者,联系原辅料的供应商内控其细菌内毒素限度,使原辅包细菌内毒素限度总和小于制剂细菌内毒素限度,或将细菌内毒素检查项定到中间产品标准,个人倾向于通过联系原辅料的供应商内控其细菌内毒素限度,使原辅包细菌内毒素限度总和小于制剂细菌内毒素限度,从而科学合理的制定细菌内毒素控制策略。
4、创新药的细菌内毒素控制策略
创新药的细菌内毒素控制策略与仿制药一致,关注的重点是细菌内毒素限度的确定,需要:
①符合中国药典;
②符合ICH成员国中最严药典标准(便于国际注册);
③考虑未来的联合用药情况;
④考虑体弱患者用药情况;
因此,制定相应品种细菌内毒素限值时,可在计算值的基础上适当严格。
5、总结:劝君更尽一杯酒,西出阳关无故人
本文通过对细菌内毒素和热源、各国细菌内毒素标准、仿制药的细菌内毒素控制策略、创新药的细菌内毒素控制策略这四部分的思考,就如何科学、合理的制定注射剂细菌内毒素控制策略进行了探讨,注射剂通过原辅包控制、设备清洁验证、成品检测,来实现制剂全生命周期的细菌内毒素控制策略是具有可行性和科学性的。
参考文献:
1.《中国药典》(2020版四部1143 细菌内毒素检查法).
2.《中国药典》(2020版四部9251 细菌内毒素检查法应用指导原则).
3.《浅谈化学药品注射剂细菌内毒素》梦幻今朝.
4.《《中国药典》药用辅料细菌内毒素标准设定的思考》祝清芬、张娟等.

来源:药研