您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-13 08:56
摘 要: 建立高效液相色谱法测定对乙酰氨基酚片中硫脲的含量。样品用流动相提取后,用Shim-pack GIST C8色谱柱(250 mm×4.6 mm,5 μm)分离,以磷酸盐缓冲液-甲醇(体积比为90∶10)为流动相,等度洗脱,流量为0.5 mL/min,柱温为40 ℃,检测波长为236 nm,进样体积为10 μL。硫脲的质量浓度在0.102~10.205 μg/mL范围内与色谱峰面积线性关系良好,相关系数为0.999 9,方法检出限为3.4 μg/g,定量限为8.5 μg/g。测定结果的相对标准偏差为0.8%(n=6),加标平均回收率为99.3%。该方法处理简便,检测高效,灵敏度高。
关键词: 对乙酰氨基酚片; 硫脲; 高效液相色谱法
对乙酰氨基酚片是由对乙酰氨基酚和适量辅料组成的化学药品,主要用于解热镇痛,属于非处方药物(OTC)[1‒7],是基础公卫体系必备药物之一。全国共有901个对乙酰氨基酚片批文,是典型的同名多组方药品,除主药成分相同外,因企业不同,其辅料的种类和用量均不相同,其中多用到玉米淀粉、预胶化淀粉、滑石粉、硬脂酸镁等,有部分企业在辅料中使用了硫脲。硫脲对人体具有一定的毒性,被人体吸收后,对人体的甲状腺以及造血器官造成抑制作用,从而导致心脏衰竭。有数据显示,从事硫脲生产的工人常常出现头痛、浑身乏力、上腹部疼痛,甚至出现面部肿胀、基础代谢水平降低、白细胞数量减少等症状[8]。2017年10月27日,硫脲被世卫组织国际癌症研究机构列为3类致癌物清单中。《中华人民共和国药典》 (以下简称《中国药典》) 2020年版二部和YBH06652020《国家药品标准》中均未对对乙酰氨基酚片中硫脲作相应的规定。企业也未曾建立相应的质控文件或标准,仅依据HG/T 3454—2013《化学试剂 硫脲》对入厂辅料进行检验,因此目前对乙酰氨基酚片中硫脲含量的控制存在一定的安全风险。
依据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,硫脲不能作为食品添加剂使用。而硫脲作为药用辅料,目前尚未收载《中国药典》,仅在2022年,国家药典委员会网站公布硫脲辅料征求意见稿,将硫脲作为抗氧剂使用。由于硫脲对人体具有一定的毒性,存在较大的用药安全隐患,需要建立对乙酰氨基酚片中硫脲的分析方法,以便进行风险评估及监测。目前关于硫脲分析方法的报道主要为高效液相色谱法或液相色谱-串联质谱法[9],主要集中于化工染料、面粉及其制品中硫脲的分析,而药品中硫脲的检测未见相关报道。笔者采用高效液相色谱法,将固定相C18色谱柱改为C8色谱柱,通过调整流量及流动相比例,解决了硫脲在色谱柱上的保留值小的问题。在样品处理方面,充分考虑对乙酰氨基酚及对氨基酚特性,在色谱法分析时,加入一定量的离子对试剂,以获得对称完整的色谱峰;利用硫脲易溶于水溶液的特性,采用流动相作为提取溶剂,既满足了对硫脲的提取,又确保了对乙酰氨基酚片中对乙酰氨基酚及对氨基酚有效检出。该方法可为对乙酰氨基酚片中硫脲质量控制及风险监测提供参考。
1、 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Aglient 1260型,配紫外检测器,美国安捷伦科技有限公司。
电子天平:BP211D型,感量为0.1 mg,北京赛多利斯科学仪器有限公司。
超声波清洗器:SB25-12DTD/V型,宁波新芝生物科技股份有限公司。
磷酸二氢钠:分析纯,国药集团化学试剂有限公司。
40%的四甲基氢氧化铵溶液:分析纯,国药集团化学试剂有限公司。
甲醇、乙腈:均为色谱纯,美国默克公司。
硫脲对照品:纯度(质量分数)为100.0%,批号为410002-201201,中国食品药品鉴定研究院。
对氨基酚对照品:纯度(质量分数)为100.0%,批号为100802-202005,中国食品药品鉴定研究院。
对乙酰氨基酚对照品:纯度(质量分数)为99.9%,批号为100018-202111,中国食品药品鉴定研究院。
实验用水为超纯水。
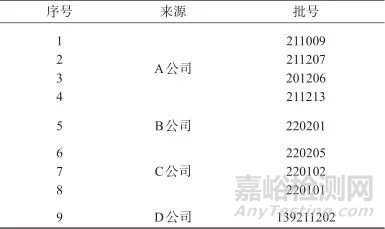
对乙酰氨基酚片样品:共9批,均为吉林省四平市食品药品检验所2022年监督抽验专项任务抽验样品,基本信息见表1。
表1 对乙酰氨基酚片信息
Tab. 1 Paracetamol tablets information
1.2 仪器工作条件
色谱柱:Shim-pack GIST C8柱(250 mm×4.6 mm,5 μm,日本岛津仪器有限公司);柱温:40 ℃;检测波长:236 nm;进样体积:10 μL;流动相:磷酸盐缓冲液-甲醇(体积比为90∶10,下同),流量为0.5 mL/min;洗脱方式:等度洗脱。
1.3 溶液配制
磷酸盐缓冲液:称取磷酸氢二钠8.95 g,磷酸二氢钠3.9 g,加水溶解至1 000 mL,加入质量分数为10%的四丁基氢氧化铵溶液12 mL,混匀。
系统适用性溶液:分别准确称取硫脲、对氨基酚和对乙酰氨基酚对照品各10 mg,置于同一100 mL容量瓶中,用流动相溶解并稀释至标线,摇匀;准确移取上述溶液5 mL,置于10 mL容量瓶中,用流动相稀释至标线,摇匀。
硫脲对照品溶液:10 μg/mL,准确称取硫脲对照品约20.41 mg,置于50 mL容量瓶中,用流动相溶解并稀释至标线,摇匀;准确移取上述溶液2.5 mL,置于100 mL容量瓶中,用流动相稀释至,摇匀。
硫脲系列标准工作溶液:准确量取硫脲对照品溶液1、4、2、4、10 mL,分别置于100、100、10、10、10 mL容量瓶中,加入流动相稀释至标线,摇匀,得硫脲系列标准工作溶液,质量浓度依次为0.102、0.408、2.041、4.082、10.205 μg/mL。
1.4 样品处理
准确称取20片对乙酰氨基酚片的质量,并计算平均片重,研细备用。称取对乙酰氨基酚片细粉适量(约含对乙酰氨基酚0.1 g),置于10 mL容量瓶中,加入流动相适量,振摇溶解,用流动相稀释至标线,摇匀,滤过,取续滤液作为样品溶液。
1.5 测定方法
取系统适用性溶液、硫脲系列标准工作溶液和样品溶液,按照1.2仪器工作条件分别进行测定。系统适用性要求:理论板数按照硫脲色谱峰计算,不低于8 000,硫脲、对氨基酚、对乙酰氨基酚色谱峰之间的分离度均不小于3.0。以色谱峰面积外标法计算硫脲相对主成分含量。
2、 结果与讨论
2.1 色谱柱选择
由于硫脲在色谱柱上保留值较小,优选C8色谱柱,并将流量降低至0.5 mL/min,以增加其在色谱柱上的保留值。分别比较了Carpisil C8柱(250 mm ×4.6 mm,5 μm)、InerSustain C8柱(250 mm ×4.6 mm,5 μm)、BDS HypersilTM C8柱(250 mm ×4.6 mm,5 μm)、Shim-pack GIST C8柱(250 mm ×4.6 mm,5 μm)四种型号色谱柱的分离效果,结果均满足系统适用性要求,相同条件下Shim-pack GIST C8色谱柱获得的色谱图中对氨基酚与对乙酰氨基酚色谱峰对称性更好(如图1所示),且硫脲色谱峰理论板数更高,故选择Shim-pack GIST C8色谱柱(250 mm ×4.6 mm,5 μm)。
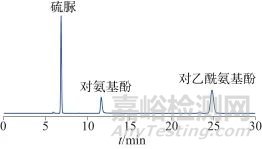
图1 系统适用性溶液色谱图
Fig. 1 System suitability solution chromatogram
2.2 柱温选择
选用Shim-pack GIST C8色谱柱,考察柱温分别为35、40、45 ℃时硫脲的测定结果。结果表明,除保留时间不同外,硫脲的测定结果无明显差异。当柱温为35 ℃时,系统适用性溶液色谱图中,对氨基酚和对乙酰氨基酚色谱峰拖尾因子较大;当柱温为45 ℃时,硫脲与对氨基酚色谱峰分离度为3.1;当柱温为40 ℃时,硫脲与对氨基酚色谱峰分离度为4.6。综合考虑,选择柱温为40 ℃。
2.3 流动相选择
液相色谱法测定硫脲时,流动相可以选择甲醇-乙腈-水(5∶5∶90)、磷酸二氢铵(用磷酸调节pH至3.0)-甲醇(98∶2)和乙腈-水(梯度洗脱)[10‒15]。由于硫脲相对分子质量较小,其结构式存在C=S和—NH2,应首选极性较大的流动相。对乙酰氨基酚和对氨基酚分子结构中存在苯环与氮氢键的共轭体系,选择流动相时考虑加入离子对试剂,以增加色谱峰的对称性。参考《中国药典》2020年版二部中对乙酰氨基酚片项下对氨基酚检测方法及有关物质分析的流动相,分别选择磷酸盐缓冲液(磷酸氢二钠8.95 g、磷酸二氢钠3.9 g,加水溶解至1 000 mL,加入质量分数为10%的四丁基氢氧化铵溶液12 mL)-甲醇(90∶10)和甲醇-缓冲液(磷酸氢二钠十二水合物8.96 g、磷酸二氢钠二水合物3.91 g溶于1 000 mL水中,加入质量分数为40%的四丁基氢氧化铵溶液1.53 g) (10∶90)两种流动相体系进行试验。结果发现,两种流动相均可以将硫脲、对氨基酚和对乙酰氨基酚有效分离,但是,前者获得的对氨基酚色谱峰对称性更好,故选择磷酸盐缓冲液-甲醇(90∶10)为流动相。
2.4 检测波长选择
取对氨基酚、对乙酰氨基酚和硫脲对照品,用体积分数为40%甲醇溶液分别配制成质量浓度均为1.0 μg/mL的溶液,采用岛津UV-2450型紫外可见分光光度计进行光谱扫描。结果表明,对氨基酚的最大吸收波长为233 nm和301 nm;对乙酰氨基酚最大吸收波长为248 nm;硫脲最大吸收波长为236 nm。
取系统适用性溶液,按照1.2仪器工作条件,利用DAD紫外检测器在200~400 nm范围内对对氨基酚、对乙酰氨基酚和硫脲扫描。结果发现,对氨基酚最大吸收波长变为232 nm和298 nm;对乙酰氨基酚最大吸收波长变为244 nm;硫脲最大吸收波长依然为236 nm,由此可见,当加入四丁基氢氧化铵后,影响了分子内电子云排布,导致最大吸收波长的位移,而硫脲分子结构简单,则不受影响,故选择236 nm作为检出波长。
2.5 样品处理方法优化
由于硫脲易溶液于水,在溶剂的选择过程中,分别考察水、40%甲醇溶液和流动相作为提取溶剂的提取效果。结果发现,3种提取溶剂均可将硫脲完全提取出来,但是以水作为提取溶剂时,对氨基酚和对乙酰氨基酚的提取效果不尽理想;以40%甲醇溶液和流动相为提取溶剂时,两者的提取效果类似,但40%甲醇溶液会出现溶剂效应,影响硫脲和对氨基酚色谱峰的对称性,因此选择流动相作为提取溶剂。
分别比较了振摇和超声两种提取方式,提取时间均分别为5 min和10 min。结果表明,振摇5 min与超声5 min时,对硫脲、对氨基酚和对乙酰氨基酚的提取效果一致。两种提取方式10 min的提取效果与5 min一致,考虑提取操作性及能耗因素,优选振摇作为提取方式。当溶剂充分接触药粉时,适当振摇即可完全提取,故提取时间不做具体规定。该处理方法获得的样品溶液分别于第0、2、4、6、8、12、24 h时,在1.2色谱条件下进样分析,硫脲色谱峰面积测定结果的相对标准偏差为0.1%,表明该方法处理的样品溶液在24 h内稳定。
2.6 专属性试验
取A企业提供的辅料,按照A样品规格及片重,除硫脲外,称取100片量的阴性原辅料,并充分混匀,得阴性样品。按照1.4方法处理,得阴性样品溶液。取硫脲对照品溶液、阴性样品溶液、加标样品溶液,在1.2仪器工作条件下分别进行测定,结果如图2所示。由图2可以看出,阴性辅料在硫脲色谱峰保留时间处无干扰,硫脲与对乙酰氨基酚充分分离,该方法专属性良好。
2.7 线性方程和检出限
在1.2仪器工作条件下,分别测定硫脲系列标准工作溶液,以硫脲质量浓度为横坐标,以色谱峰面积为纵坐标,绘制标准工作曲线。硫脲的质量浓度在0.102~10.205 μg/mL范围内与色谱峰面积有良好的线性关系,线性方程为y=177.511x+3.895,相关系数为0.999 9。
在阴性样品中加入低浓度的硫脲标准溶液,按照1.4方法进行样品处理,在1.2仪器工作条件下测定,计算硫脲色谱峰信噪比,分别以3倍和10倍信噪比对应的样品中硫脲的质量分数作为方法检出限和定量限,对乙酰氨基酚片中硫脲的检出限为3.4 μg/g,定量限为8.5 μg/g。
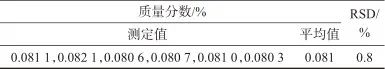
2.8 精密度试验
取A公司批号为211207的样品,按照1.4样品处理方法,平行制备6份样品溶液,在1.2色谱条件下测定,结果见表2。由表2可知,6次测定结果的相对标准偏差为0.8%,表明该方法精密度良好。
表2 精密度试验结果
Tab. 2 Precision test results
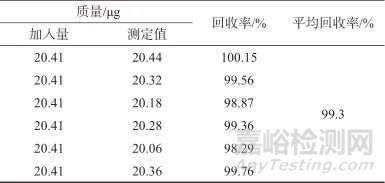
2.9 加标回收试验
精密称取阴性样品约0.12 g,置于10 mL容量瓶中,精密加入质量浓度为10.205 μg/mL的硫脲对照品溶液2 mL,按照样品溶液同法处理6份加标样品溶液,在1.2仪器工作条件下测定,计算回收率,结果见表3。由表3可知,加标平均回收率为99.3%,表明该方法准确度良好。
表3 加标回收试验结果
Tab. 3 Results of spiked recoveries test
3、 结语
建立了高效液相色谱测定对乙酰氨基酚片中硫脲含量的分析方法。该方法专属性、精密度、重复性和准确度良好,操作简便,可为对乙酰氨基酚片的安全用药和标准完善提供依据。
参考文献
1 肖江,王辉,帅海涛,等.高效液相色谱法检测对乙酰氨基酚片中有关物质[J].中国药业,2022,31(21):55.
XIAO Jiang,WANG Hui,SHUAI Haitao,et al. Determination of related substances in Paracetamol Tablets by HPLC[J]. China Pharmaceuticals,2022,31(21):55.
2 张涛,张梦,郝建平等.对乙酰氨基酚片质量与疗效一致性评价综述[J].中国医药工业杂志,2021,52(10):1 304.
ZHANG Tao,ZHANG Meng,HAO Jianping,et al. A review on quality and efficacy consistency evaluaion of Paracetamol Tablets[J]. Chinese Joural of Pharmaceuticals,2021,52(10):1 304.
3 黄小雨,杜润华,隋继英等.对乙酰氨基酚片体外溶出与体内吸收的相关性评价[J].药物生物技术,2019,26(5):389.
HUANG Xiaoyu,DU Runhua,SUI Jiying,et al. Evaluation on the in vitro dissolution and in vivo absorption correlation of Acetaminophen Tablets[J]. Pharmaceutical Biotechnology,2019,26(5):389.
4 聂忠莉,马婕,王晓玲等.对乙酰氨基酚片仿制药与原研药的溶出度一致性评价[J].成都大学学报(自然科学版),2020,39(1):32.
NIE Zhongli,MA Jie,WANG Xiaoling. Consistency evaluation of dissolution of generic and original preparations of Paracetamol Tablet[J]. Jouranal of Chengdu Universtiy (Natural Science Edition),2020,39(1):32.
5 杨莉,梅勇,龙涛,等. HPLC法测定对乙酰氨基酚片中有关物质的含量[J].中国药房,2020,31(10):1 233.
YANG Li,MEI Yong,LONG Tao,et al. Content determination of related substances in Paracetamol Tablets by HPLC[J]. China Pharmacy,2020,31(10):1 233.
6 覃鹏,刘娅婷,蒋成君.对乙酰氨基酚多晶型控制策略研究进展[J].浙江化工,2023,54(8):28.
Qin Peng,LIU Yating,JIANG Chengjun. Research progress on acetaminophen polymorphism control strategies[J]. Zhejiang Chemical Industry,2023,54(8):28.
7 肖艳,高永坚,梁标志,等.对乙酰氨基酚片沿刻痕分割后的药学质量评价[J].海峡药学,2023,35(1):47.
XIAO Yan,GAO yongjian,LIANG Biaozhi,et al. Tablet scoring feature evaluation for Acetaminophen Tablets after tablets plitting[J]. Stait Parmaceutical Journal,2023,35(1):47.
8 焦安浩.硫脲的危险性及安全管理措施研究[J].化工管理,2021(7):95.
JIAO Anhao. Study on the dangers of thiourea and safety management measures[J]. Chemical Engineering Management,2021(7):95.
9 王妍,李志刚,赵文涛,等.超高效液相色谱-串联质谱法同时测定小麦粉中硫脲、曲酸、噻苯咪唑、噻二唑、四环素[J].食品科学,2021,42 (22):324.
WANG Yan,LI Zhigang,ZHAO Wentao,et al. Simultaneous determination of thiourea,kojic acid,thiabendazole,thiadiazole and tetracycline in flour by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2021,42(22):324.
10 王邱,何海彤,李锦清,等.高效液相色谱法对小麦粉及其制品中硫脲的测定[J].粮油食品科技,2022,30(6):130.
WANG Qiu,HE Haitong,LI Jinqing,et al. High Performance liquid chromatography (HPLC) method for the determination of thiourea in wheat flour and its products[J]. Science and Technology of Cereals,Oils Foods,2022,30(6):130.
11 李茜,梅芊,刘英. UPLC-MS/MS法测定乙酰唑胺及其制剂中双硫脲杂质的含量[J].药物分析杂志,2021,41(8):1 423.
LI Xi,MEI Qian,LIU Ying. Determination of dithiobiurea in acetazolamide and its preparations by UPLC-MS/MS[J]. Chinese Journal of Pharmaceutical Aanlysis,2021,41(8):1 423.
12 叶明立,卢浈乐,NESTERENKO P N.等.反相色谱和离子交换色谱测定三聚氰胺氰尿酸中三聚氰胺与硫脲的对比研究[J].分析仪器,2020(6):162.
YE Mingli,LU Zhenle,NESTERENKO P N. et al. Comparative investigation on determination of melamin and thiourea in melamine-cyanuric acid complex by reversed phase liquid chromatography and ion exchange chromatography[J]. Aanlytical Instrumentatin,2020(6):162.
13 任兴权,王蓉,侯莉莉,等.高效液相色谱-二极管阵列检测器法测定面粉及其制品中的硫脲[J].食品科技,2020,45(5):323.
REN Xingquan,WANG Rong,HOU Lili,et al. Determination of thiourea in flour and its products by high performance liquid chromatography with diode array detector[J]. Food Science and Technology,2020,45(5):323.
14 黄晓兰,罗辉泰,吴惠勤,等.液相色谱-串联质谱测定面条和米粉中的硫脲[J].分析化学,2009,37(10):1 531.
HUANG Xiaolan,LUO Huitai,WU Huiqin,et al. Determination of thiourea in noodle and rice flour by liquid chromatography-mass spectrametry[J]. Chinese Journal of Analytical Chemistry,2009,37(10):1 531.
15 何瑞云,李莉,张鑫,等.高效液相色谱法测定面粉及其制品中的硫脲[J].食品安全质量检测学报,2017,8(7):2 471.
HE Ruiyun,LI li,ZHANG Xin,et al . Determination of thiourea in flour and flour products by high performance liquid chromatography[J]. Journal of Food Safety and Quality,2017,8(7):2 471.

来源:化学分析计量