您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-06-14 17:47
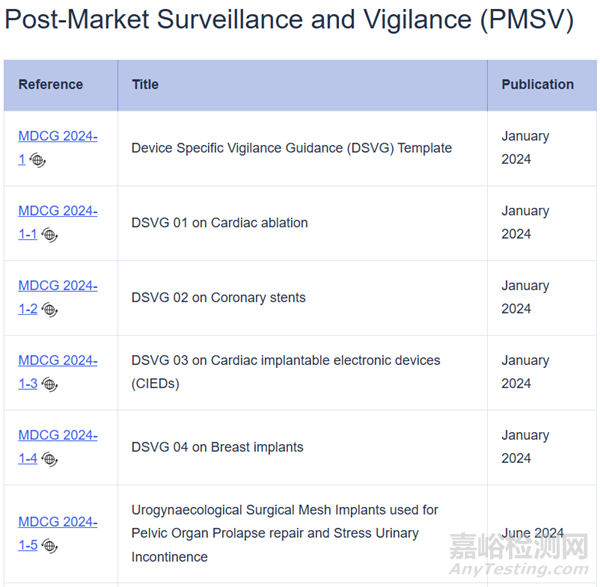
2024年1月份,MDCG发布了心脏消融手术器械、冠状动脉支架、心脏植入式电子器械、乳房植入物4种特定器械的警戒系统指南,以及一份特定器械警戒系统指南模板;2024年6月11日又推出了MDCG 2024-1-5用于盆腔器官脱垂修复和压力性尿失禁的泌尿妇科手术网状植入物的警戒指南。不难看出,往后还会有其他器械的警戒系统指南发布。欧盟对上市后监管和警戒这一模块的重视,医疗器械制造商应引起注意。今天小编以最新发布的MDCG 2024-1-5为例进行解读。
介 绍
本指南旨在协调警戒报告,并为用于盆腔器官脱垂修复和压力性尿失禁的泌尿妇科手术网状植入物的制造商提供指导。本指南进一步明确了向相关主管当局对这种特定器械进行警戒性上报的问题,制造商应注意警戒上报应结合MDR的要求进行。
应报告的内容
制造商有责任根据每起事件的具体情况作出判断,并确保符合MDR中的上报要求。
单个严重事件
严重事件是指直接或间接导致、可能已导致或可能会导致以下任一状况的事件:
a. 患者、使用者或其他人员的死亡;
b. 患者、使用者或其他人员健康状态的暂时性或永久性严重恶化;
c. 严重公众健康威胁。
医疗器械制造商应根据MDR Art. 87在规定的时限内向相关主管当局报告严重事件,包括制造商不确定特定器械发生的事件是否应报告或需要时间澄清事件根源的情况。
定期总结报告
当发生涉及同一特定器械或器械类型的类似严重事件,且已确定根本原因或已实施现场安全纠正措施时,或严重事件是常见且完整记录的,在这种情况下制造商可集中报告同一器械或器械类型发生的类似严重事件,提供定期总结报告。关于定期总结报告的格式、内容和频率,制造商应与负责协调定期总结报告的国家主管当局协商。
在EUDAMED全面运作之前,主管当局、经济运营商和其他相关方应遵循MDCG 2021-1 Rev. 1 "Guidance on harmonised administrative practices and alternative technical solutions until EUDAMED is fully functional"中的要求执行。
趋势报告
MDR Art.88规定,如果非严重事件或预期不良副作用的发生频率或严重程度在统计学上有显著增加,并对受益-风险分析产生重大影响;在衡量预期受益时,事件已经导致或可能导致对患者、使用者或其他人的健康或安全造成不可接受的风险,则制造商应向主管当局报告。制造商应确定这些趋势,因为这些趋势可能表明受益-风险比发生了变化。关于构成事件和不良副作用的进一步信息和说明,可参考MDCG 2023-3。
临床参考和临床指南
制造商在确定事件实例和并发症时,可参考用于盆腔器官脱垂修复和压力性尿失禁的泌尿妇科手术网植入物的临床参考资料或现行临床指南,也可参考当地的相关临床指南。
关于警戒系统报告中涉及的IMDRF不良事件代码以及本指南特定器械的警戒报告示例,有兴趣的读者可点击下方的参考资料进一步了解。
参考资料:
MDCG 2024-1-5 Guidance on the vigilance system for CE-marketed devices - DSVG 05 - Urogynaecological Surgical Mesh Implants used for Pelvic Organ Prolapse repair and Stress Urinary Incontinence

来源:苏大检测