您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-11 13:15
同品种比对是医疗器械注册申报过程中进行临床评价的重要方式之一,包括通过等同器械的临床数据进行临床评价以及使用可比器械的临床数据进行部分临床评价。它可以有效地帮助企业节省大量研发费用,缩短新产品上市时间。
那么在医疗器械注册过程中哪些产品适合做同品种比对?医疗器械同品种比对要如何做,数据如何收集?本文将为大家进行详细介绍。
1、哪些产品适合做同品种比对
根据《医疗器械注册与备案管理办法》(2021年8月26日 国家市场监督管理总局令第47号)规定和要求,医疗器械临床评价可分为三种情况:1.免于进行临床评价;2.同品种比对;3.临床试验。
其中免于进行临床评价的医疗器械目录由国家药品监督管理局制定、调整并公布。
适用于同品种比对的产品,一般应具备以下特点:
1、技术特征相似:与同品种产品在基本原理、结构组成、生产工艺等方面具有相似性。
2、适用范围相同或相近:能够覆盖同品种产品的适用人群、适用部位及适应症。
4、安全性有效性已得到临床公认:同品种产品的安全有效性在现有认知下已得到广泛认可。
例如,有源手术器械、医用成像器械、骨科手术器械等,由于其技术成熟、市场应用广泛,因此较适合进行同品种比对。
关于具体产品采用哪种临床评价路径,国家药品监督管理局也会不定期发布通告,对医疗器械分类目录中相关产品的临床评价推荐路径进行说明。
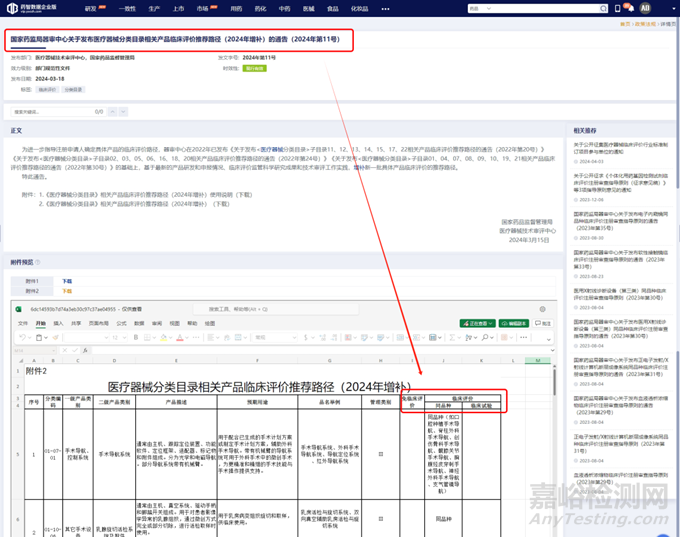
图片来源:药智医械数据-政策法规数据库
此外,药智医械数据-中国上市器械筛选系统根据国家药监局公布信息及医疗器械分类,也对各类医疗器械产品进行了推荐临床路径标注与筛选,用户在查询医疗器械产品的同时就能清楚其推荐临床路径。
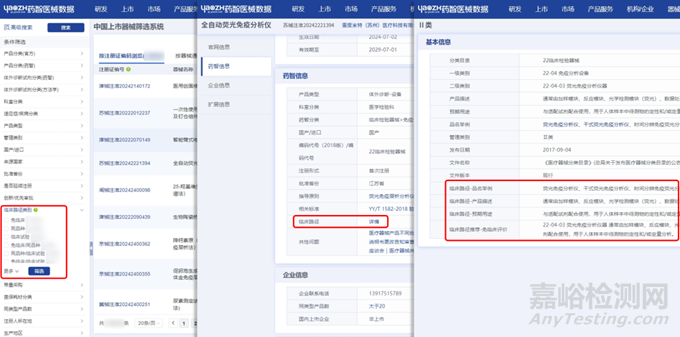
图片来源:药智医械数据-中国上市器械筛选系统、中国医疗器械分类目录
2、如何做医疗器械同品种比对
医疗器械同品种比对大致包括5个步骤:
1、确定同品种医疗器械
根据申报产品的技术特征和适用范围,筛选出合适的同品种医疗器械。通常是前往国家药品监督管理局官网查询相同或相似产品名称,然后逐个产品进行对比,但这个方式相对比较耗时,而且往往查询结果不够全面。药智医械数据-中国上市器械筛选系统支持对结构及组成、适用范围进行检索,更支持通用名查询,可以一次性检索出更为全面的同品种医疗器械产品。
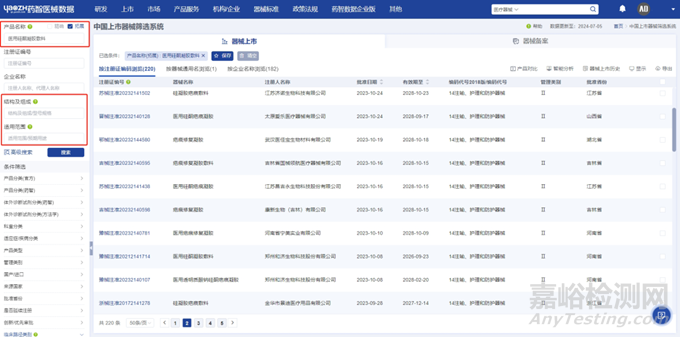
图片来源:药智医械数据-中国上市器械筛选系统
此外,中国上市器械筛选系统还支持单次对最多10个产品进行横向对比,从而直观了解各产品结构组成、适用范围等维度异同,便于筛选出更为合适的同品种产品。
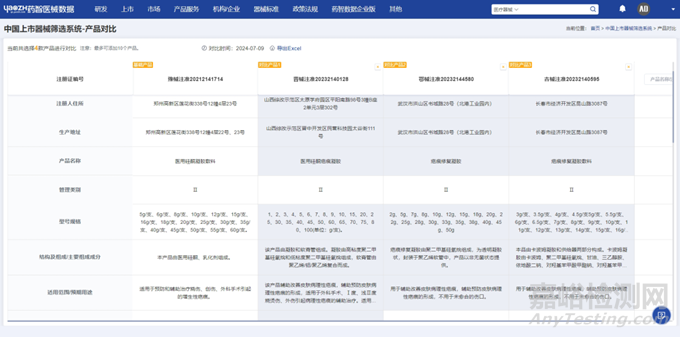
图片来源:药智医械数据-中国上市器械筛选系统
2、收集对比资料
包括同品种医疗器械的临床数据、技术文件、使用说明书、不良事件等信息,这些资料将作为比对分析的基础,因此需要确保其全面、精准、具有可重复性。这里同样可以通过药智医械数据——中国地方药监局注册产品信息、全球医疗器械产品说明书、文献等数据库进行相关资料查找。
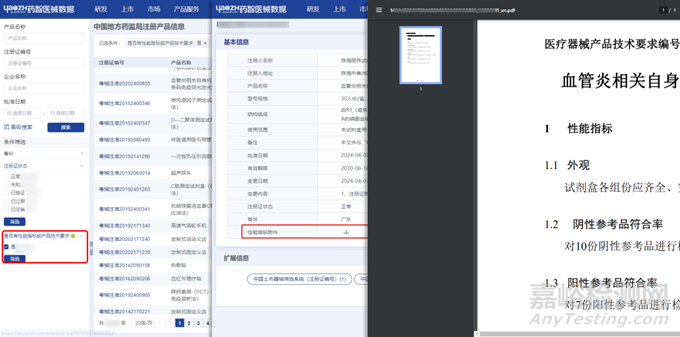
图片来源:药智医械数据-中国地方药监局注册产品信息
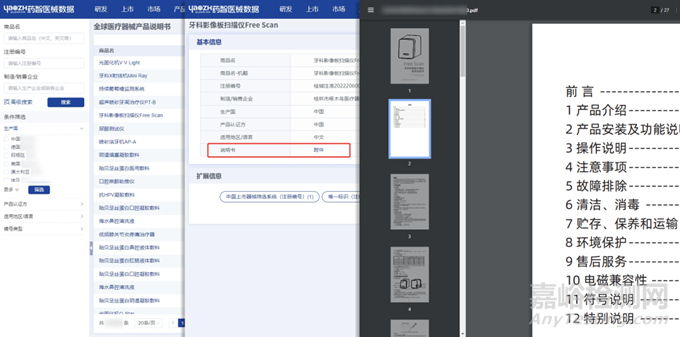
图片来源:药智医械数据-全球医疗器械产品说明书
3、详细对比分析
按照《医疗器械临床评价技术指导原则》的要求,对申报产品与同品种产品在基本原理、结构组成、生产工艺、性能要求、安全性评价等方面进行逐项对比,确保两者在关键指标上基本一致。详细列出申报产品与同品种产品的差异点,并论证这些差异点是否对产品的安全、有效产生不利影响。

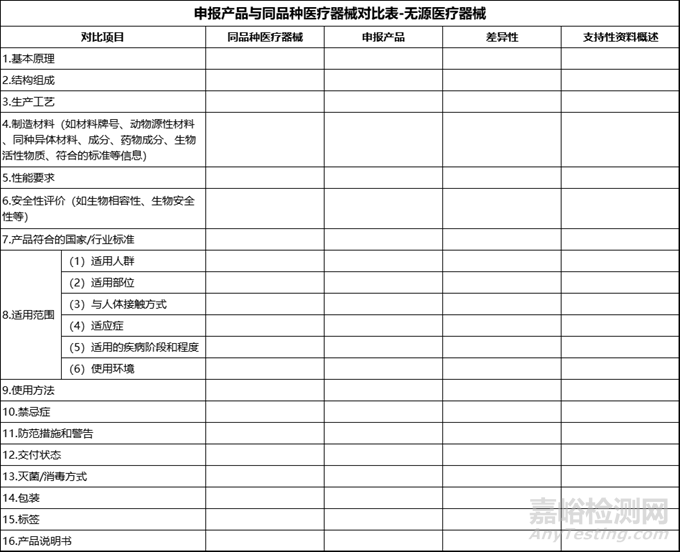
图片来源:医疗器械临床评价技术指导原则,零度自制
4、临床数据分析评价
对同品种医疗器械的临床数据进行质量评价、数据集建立、统计分析、数据评价等,以确认其安全性和有效性。
5、形成临床评价报告
综合上述分析,参考《医疗器械注册申报临床评价报告技术指导原则》附件的要求和格式,编写临床评价报告,作为医疗器械注册的依据。
3、同品种比对数据获取及注意事项
在获取和使用同品种比对数据时,应注意以下事项:
1、数据合法性:确保所使用数据的合法性和真实性,避免侵犯他人知识产权。
2、数据全面性:尽可能收集全面的同品种比对数据,以保证分析结果的准确性和可靠性。
3、数据时效性:关注同品种医疗器械的最新研究进展和临床数据更新,确保比对分析结果的时效性。
4、合规性:在整个同品种比对过程中,应严格遵守相关法律法规和监管要求,确保注册过程的合规性。
由于医疗器械产品的这些信息过于分散,在实际工作中,绝大多数产品的相关信息都很难快速找到。因此,同品种比对产品数据的获取成为广大医疗器械注册人进行同品种比对的主要难点。

来源:药智医械数据


