您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-17 20:23
无菌检查法是无菌药品检查的法定检验方法,其中薄膜过滤法因易操作、风险低和准确度高等优点比直接接种法应用更广泛。无菌药品剂型种类繁多,其中抗生素类药品因品种结构多变、抑菌性强和抗菌谱广等因素,一直以来是建立无菌检查方法的难点。本文就薄膜过滤法中的溶解、过滤、冲洗和培养等4个关键步骤展开讨论,通过对已建立的13类47个品种共61个抗生素药品无菌检查方法的综述,探讨建立无菌检查方法的基本策略,并对无菌检查方法和结果的局限性进行讨论,以期为建立抗生素类无菌药品无菌检查方法及正确认识无菌检查结果提供思路和参考。
药品无菌检查法最早于1932年收载于《英国药典》(British Pharmacopoeia, BP)[1],《中国药典》第一版于1953年收载有“药品无菌检验法”[2],用于判断药品是否满足无菌特性。经过几十年的技术发展,药品无菌概念亦不断变化,如今,无菌检查的结果是评估药品在规定的检验条件下是否满足质量标准要求的一个关键指标,而确认药品的无菌特性更重要的是需要结合无菌生产工艺、数据记录和质量监控等,构建无菌保障体系。药品进行无菌检查主要用于检测由于技术故障、人为失误、混淆灭菌与非灭菌物品等因素引起的污染,是生产企业和监管机构用于成品无菌性检测的唯一可用的分析方法[3-4],也是GMP检查的主要内容之一[5]。
无菌检查法包括薄膜过滤法和直接接种法。无菌药品可大致可分为注射剂、眼用制剂、无菌固体原料和抗生素原料药等。其中,注射剂中抗生素类药品的市场占有份额较大,应用最为广泛。在进行无菌检查时,通常只要供试品性质允许,应首选薄膜过滤法。薄膜过滤法最早于1964年用于抗生素样品[6],一般采用封闭体系,具有操作方便、不易污染、结果准确等优势[7]。
抗生素类药品用于治疗细菌、真菌等引起的感染类疾病。按结构可分为β-内酰胺类、四环素类、氯霉素、大环内酯类、硝基咪唑类、氨基糖苷类、喹诺酮类、三唑类和蒽环类等[8]。抗生素类药品抑菌性强、抗菌谱广,大多数样品难以去除抑菌性,一直以来是建立无菌检查方法的重点和难点。本文以抗生素类药品的无菌检查方法为研究对象,从溶解、过滤、冲洗和培养4个主要环节,总结文献中61个采用薄膜过滤法的案例,剖析无菌检查方法开发的要点,建立消除抗生素类产品抑菌性的策略,以期为开发类似药物或新品种的无菌检查方法提供思路和参考。
1、建立无菌检查方法的过程拆解
对抗生素药品开展无菌检查时,首先应消除抗生素的抑菌性对实验的影响。消除抗生素抑菌性的途径主要包括降低抗生素初始浓度、选择合适的冲洗液(可添加中和剂)、增加冲洗量、滤膜材质的筛选、培养基的体积及是否添加中和剂等。表1对13类共47种抗生素品种的无菌方法按其结构进行了汇总,下文将从溶解、过滤、冲洗和培养4个维度分别讨论各类抗生素药品无菌检查的难点及解决办法。
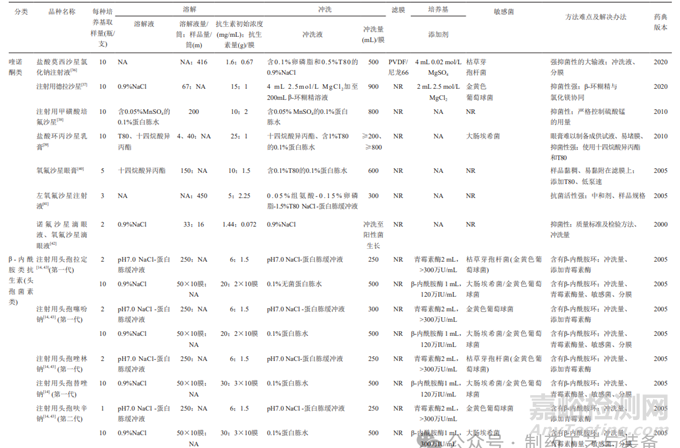
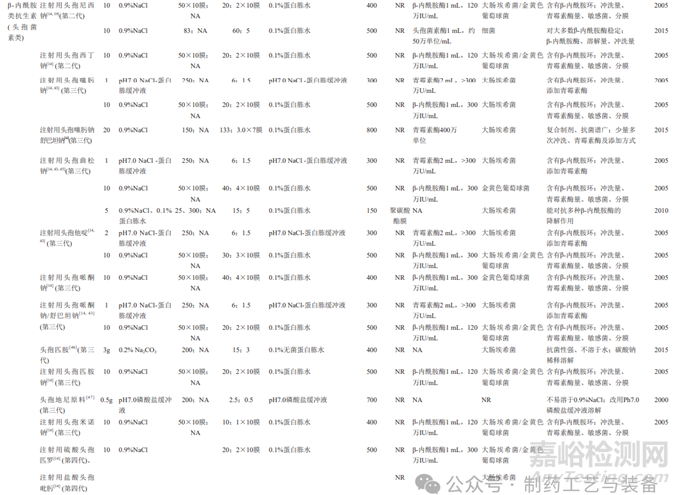

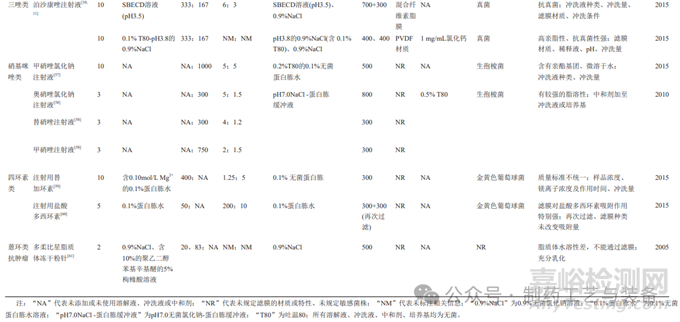
表1 13类共47种抗生素无菌检查方法
1.1溶解
样品溶解过程需要兼顾抽样方式的特点及取样量。固体注射用粉针剂,需要选择适宜的溶解液[9],同时考虑稀释样品所需的溶解液量。抗生素供试液除了应具有易过滤的特点外,还要考虑抗生素在滤膜表面的吸附、残留等问题。供试液中抗生素的初始浓度决定了每张膜过滤的抗生素量,其对于消除抑菌性也很重要,表1中虽然有少数方法中抗生素的浓度超过50mg/mL,但73%的方法中抗生素的初始浓度均控制在25mg/mL的范围内(图1);80%的方法能够将每张滤膜过滤抗生素的量控制在5g的范围内,剩余的方法每张滤膜过滤抗生素最高量为10g(图2)。结合表1数据可知,当抗生素浓度或每张滤膜过滤抗生素的量较高时,所建立的方法要么冲洗量较大,要么需添加高效中和剂,如青霉素酶、金属离子等降低冲洗量,要么使用特殊材质的滤膜,如低吸附的尼龙膜等,或多种方法联用,以消除其强抑菌性。
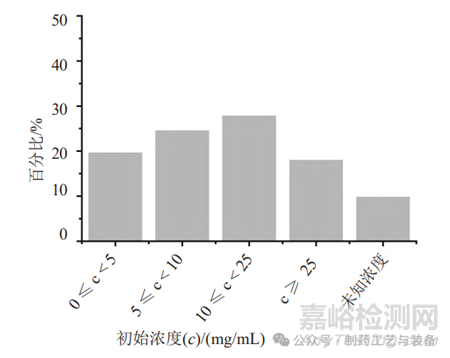
图1 61种无菌检查方法中抗生素在不同初始浓度(c)所占百分比
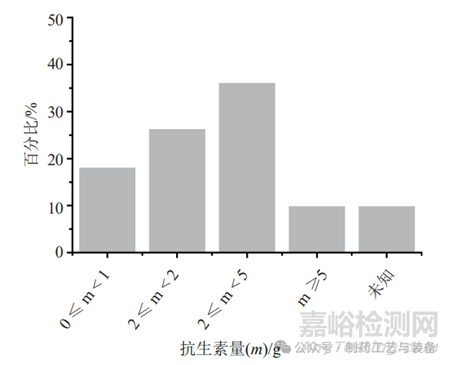
图2 61种无菌检查方法中每张滤膜过滤不同重量(m)的抗生素所占百分比
1.2过滤
过滤《中国药典》规定薄膜过滤法所用滤膜的孔径为0.45μm[7],但未规定滤膜的种类和材质。考虑到抗生素类样品若吸附残留在滤膜上,抑菌性难以去除。因此,选择低吸附的滤膜材质,也是建立抗生素无菌方法的一个考虑要点。常用的滤膜材质有醋酸纤维素膜、硝酸纤维素膜、醋酸和硝酸混合纤维素膜、尼龙膜、聚偏二氟乙烯膜等,不同材质的滤膜具有不同的适用范围及优缺点。抗生素在滤膜上的吸附特性通常以每张膜上抗生素的残留量来表示,有报道表明,泊沙康唑在不同材质滤膜上的残留量明显不同[10]。由表1可知,筛选出的具有低吸附特性的滤膜大多为聚偏二氟乙烯膜(polyvinylidene fluoride,简称PVDF)或尼龙膜,纤维素膜较少;少数使用滤膜厂家标注为特殊材质或抗生素专用滤膜,由于未明确材质的具体种类,对使用者选择滤膜的参考价值较小;由于生产工艺的差异,相同材质不同品牌滤膜的结构和性能亦可能存在差异,因而不同研究团队对相同抗生素品种筛选出的具有最低吸附特性的滤膜可能略有不同[10-11]。此外,对于难以过滤的样品如眼膏剂等,应关注过滤参数(如:泵速/泵压);若使用有机溶剂等特殊溶剂,应关注滤膜使用前后的完整性[12-13];对具有高残留、高抑菌性的样品,可采用分膜过滤的方式[14];对于易堵膜的样品,可采用双膜过滤的方式等[15]。
1.3冲洗
建立无菌检查方法时,选择适宜的中和剂和优化冲洗量是冲洗过程中需要摸索的两项最重要的实验因素(图3)。
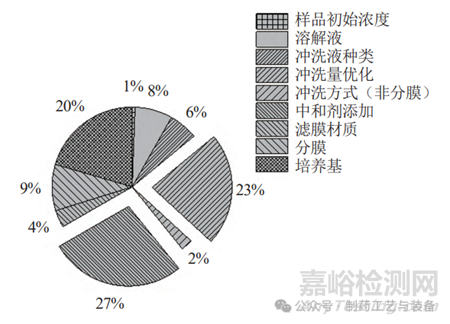
图3 开发61种无菌检查方法时各要素出现的频率
1.3.1 中和剂
《中国药典》列出了常见干扰物的对应中和剂[16]。然而,抗生素因种类繁多且抑菌活性强,添加1种中和剂有时无法消除抑菌活性,需要几种中和剂联合使用或探索新型高效的中和剂以适用于样品的性质。
卵磷脂和吐温80是应用最广泛的非特异性中和剂,具有表面活性,且与非离子具有较好的相容性[17];青霉素酶是最常用的β-内酰胺酶,对多种β-内酰胺类(如青霉素)抗生素具有水解活性,是首选的中和剂,但浓度较高时,也可抑制微生物生长[18]。此外,不同类型的β-内酰胺酶,如头孢菌素酶(50万单位头孢菌素酶与600万单位青霉素酶对去除头孢尼西钠的抑菌活性相当)[19]、金属酶(25万单位金属酶与600万单位青霉素酶对去除亚胺培南的抑菌活性相当)[20]等对相应的β-内酰胺品种具有较高的水解活性。二价金属离子,如镁离子、钙离子和锰离子等与喹诺酮类抗生素可形成络合物,使其抗菌活性减弱,因而常用作喹诺酮类抗生素的中和剂,但也应注意其对微生物生长的影响[21-22]。此外,也可尝试使用新型的中和剂,如利用β-环糊精对抑菌物质的包埋作用、表面活性剂的乳化作用等抑制特定抗生素的抑菌活性。
1.3.2 冲洗量
《中国药典》规定薄膜过滤法的冲洗量一般不超过500 mL,最高不得超过1000 mL[7],以防止冲洗对微生物的损伤和对滤膜截留能力的影响。通常样品供试液本身具有一定的体积,而《中国药典》仅建议了冲洗液的体积,若供试液体积较大,也可能会影响滤膜的完整性。图4分析了61种方法中,供试液及冲洗液体积大于500和1000 mL所占的比率。若只考虑冲洗液的影响,61%的方法冲洗量大于500 mL,7%的方法冲洗量大于1000 mL;若考虑供试液和冲洗液两者共同的影响,84%的方法冲洗量大于500 mL,15%的方法冲洗量大于1000 mL,冲洗的总体积较高。分析冲洗总体积较低的方法,大多使用了β-内酰胺酶,酶作为一种高效的中和剂,可高效消除β-内酰胺类抗生素的抑菌性,从而可有效控制冲洗量于较低的范围。
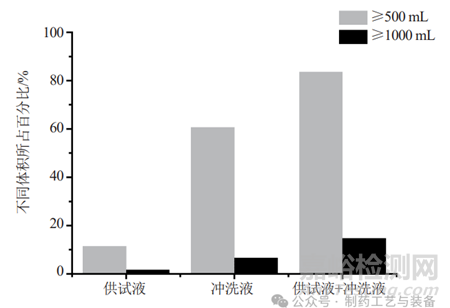
图4 61种无菌检查方法中不同体积的供试液和冲洗液所占百分比
1.4培养
不同抗生素因抗菌谱的不同使得其对代表性菌株的敏感性也不同。建立无菌方法时通常应选用最容易被抑制、最难培养、最敏感的代表性菌株作为敏感菌,保证所建立方法的有效性。图5列出了13类抗生素共61种方法所选用的敏感菌,可见,具有不同抗菌谱的不同代头孢菌素的敏感性具有明显差异(图6);同一类抗生素的不同品种也可能存在微量差异。总体来说,抗细菌类抗生素以大肠埃希菌(革兰阴性菌的代表菌株)、金黄色葡萄球菌(革兰阳性菌的代表菌株)和两者共同作为敏感菌居多,也存在枯草芽孢杆菌较为敏感的情况;应根据抗生素的抑菌特性选择敏感菌,对抗革兰阳性的抗生素,一般选择金黄色葡萄球菌;对抗革兰阴性的抗生素一般选择大肠埃希菌,具体可参考美国临床实验室标准指南(NCCLS)中对各类抗生素的MIC值[23-24]。抗厌氧类抗生素多以生孢梭菌为敏感菌;抗真菌类抗生素多以白色念珠菌为敏感菌,但也应注意黑曲霉的敏感性。敏感菌在建立无菌检查方法时作为代表菌种,可更高效、精准地建立无菌方法。
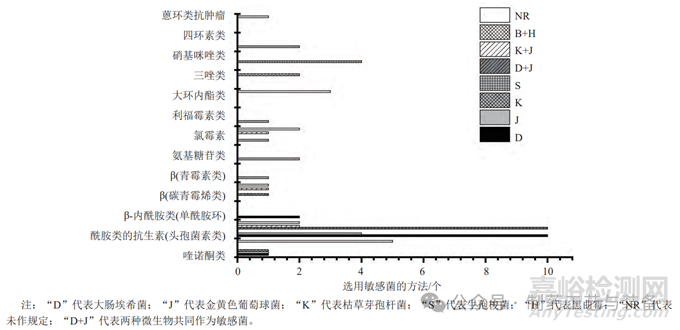
图5 在无菌检查中不同种类抗生素对应选择特定敏感菌的方法个数
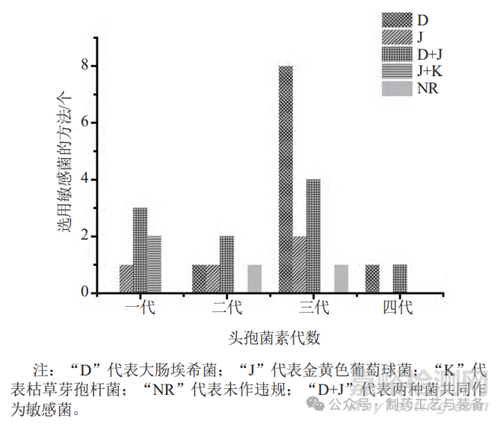
图6 在无菌检查中不同代数头孢菌素对应选择特定敏感菌的方法个数
2、讨 论
2.1建立无菌检查方法的基本策略
无菌检查过程可拆解为溶解、过滤、冲洗和培养4个关键步骤,每一步骤又可细化为多个要点(图7)。抗生素样品的抑菌性可通过稀释、冲洗、中和和转移等多种方式去除。若仅考虑中和剂和冲洗量,易导致冲洗量过大(图4),可能破坏滤膜的完整性或/和损伤微生物。影响建立无菌检查方法的因素较多(图7),多因素交叉使得其难度高、任务量大。因而,建立无菌检查的方法策略是十分重要的(图8)。首先应通过查阅文献,基于产品的特性把握关键要素设计试验方案,在此基础上以敏感菌株为指示剂开展方法预实验,最后用其他菌株验证方法的适用性。利用该策略可更加高效、科学、合理地开发无菌检查的方法。
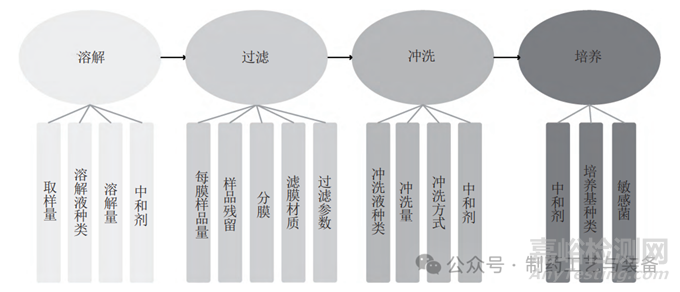
图7 建立无菌检查方法的4大步骤要点剖析
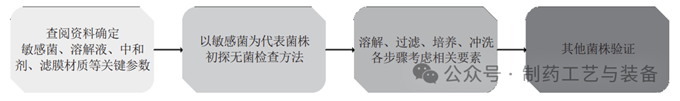
图8 建立无菌检查的方法策略
2.2无菌检查法的局限性
无菌检查法作为1种可靠的传统检验方法,仍存在主观判断、人工操作、耗时长等局限性。由于影响因素较多,无菌方法在转移过程中,可能存在不同实验室、不同仪器、不同人员、不同试剂和耗材等的差异,导致方法的适用性结果出现差异,因而应注重微生物实验室的质量控制,尽可能地保证试验结果的可靠、可重复和科学合理[25]。《中国药典》近期发布的无菌检查法公示稿中,将每张膜的冲洗量限制在500 mL[26],提示对抑菌性极强的样品开发合适的无菌方法的难度增加,且对已有方法的合规性亦应重新进行评估。此外,一些新型快检技术,如流式细胞技术[27-28]、呼吸法[29-30]、ATP生物发光[31]、等温微量热法[32]和毛细管电泳法[33]等方法具有快速、微量、自动化等优势,但仪器和耗材价格昂贵,目前已尝试用于生物制品,有望用于抗生素类药品无菌检查方法的初筛或替代。
无菌检查由于取样量较小,对于监测该批次产品的污染能力是有限的,因而结果具有一定的局限性和风险。仅根据无菌检查结果作为评价产品无菌水平的依据可能会产生误导,因为无菌检查结果阴性(无菌“合格”)可能只是无法检测到污染微生物[34],其实际产品仍可能存在污染微生物(“不合格”)。深度理解产品的无菌特性、无菌检查与无菌保证水平三者之间的关键区别,明确无菌检查的应用范围,将无菌检查与终端灭菌工艺验证、无菌生产工艺验证结合[35],是保障无菌药品质量水平的关键。
参考文献
[1] 范文平, 赵宏大, 谢文. 无菌检查试验的先天缺陷及应对策略的思考[J]. 中国药事, 2014, 28(6): 591-594.
[2] 卫生部出版社. 中华人民共和国药典[S]. (1953年版). 北京: 中国医药科技出版社, 1953: 附录42药品无菌检查法.
[3] The European Pharmacopoeia Commission. The EuropeanPharmacopoeia[S]. (11.0th Ed). Strasbourg: Council ofEurope, 2021:5.1.9 Guidelines for using the test for sterility.
[4] Australian Government Department of Health and Ageing.TGA guidelines for sterility testing of therapeutic goods[R].Therapeutic Goods Administration, 2006.
[5] Pharmaceutical Inspection Convention and PharmaceuticalInspection Co-operation Scheme. PIC/S Recommendationon Sterility Testing[R]. Pharmaceutical InspectionConvention and Pharmaceutical Inspection Co-operationScheme, 2007-9-25.
[6] Bowman F W. Application of membrane filtration toantibiotic quality control sterility testing[J]. J Pharm Sci,1966, 55(8): 818-821.
[7] 国家药典委员会. 中华人民共和国药典[S]. (2020年版第四部). 北京: 中国医药科技出版社, 2020: 1101无菌检查法.
[8] 德尼尔 S P, 霍奇 N A, 戈尔曼 S P. 药物微生物学[M]. 北京: 化学工业出版社, 2007.
[9] Cardoso V M, Solano A G R, Prado M A F, et al.Investigation of fatty acid esters to replace isopropylmyristate in the sterility test for ophthalmic ointments[J]. JPharm Biomed Anal, 2006, 42(5): 630-634.
[10] 马仕洪, 肖璜, 袁宇, 等. 泊沙康唑注射液无菌检查方法的建立[J]. 药物分析杂志, 2018, 38(9): 1568-1572.
[11] 陈青连, 姚振, 万超. 三唑类抗真菌药物泊沙康唑注射液无菌检查方法研究[J]. 中国药业, 2020, 29(17): 63-67.
[12] 冯震, 肖珊珊, 陈辉, 等. 注射用微球内部无菌检查法探讨[J]. 中国医药工业杂志, 2022, 53(12): 1761-1768.
[13] 王璐, 向东, 张艳, 等. 非水溶液氯硝西泮注射剂无菌检查法的研究[J]. 昆明医科大学学报, 2023, 44(11): 82-86.
[14] 李玮, 许威, 马仕洪. 15种注射用头孢菌素无菌检查方法研究[J]. 中国药房, 2007, 18(25): 1971-1973.
[15] 丁勃, 徐晓洁, 冷佳蔚, 等. 双滤膜过滤方法的建立及在卡波姆眼用凝胶无菌检查试验中的应用[J]. 药物分析杂志,2014, 34(5): 800-804.
[16] 国家药典委员会. 非无菌产品微生物限度检查: 微生物计数法. 中华人民共和国药典(2020年版四部)[S]. 北京: 中国医药科技出版社, 2020: 1105.
[17] 张福娥, 乔玫, 王晓瑞. 一种醋酸氯己定皮肤消毒剂的中和剂选择[J]. 中国消毒学杂志, 2018, 35(10): 746-748.
[18] Kou Y, Halpenny M, Elmoazzen H, et al. Development of aproof of principle for universal neutralization of antibioticsin cord blood by-products used for sterility testing[J].Transfusion, 2018, 58(6): 1421-1426.
[19] 肖建光, 欧国栋, 赖珊, 等. 注射用头孢尼西钠无菌检查方法的优化及关键影响因素[J]. 中国抗生素杂志, 2021,46(4): 287-290.
[20] 欧国栋, 肖建光, 赖珊, 等. 注射用亚胺培南西司他丁钠无菌检查法的优化及标准化[J]. 中国抗生素杂志, 2023,48(3): 327-332.
[21] 杨美琴, 蔡春燕, 刘鹏, 等. 盐酸莫西沙星片微生物限度检查方法讨论[J]. 中国抗生素杂志, 2022, 47(3): 245-251.
[22] 马仕洪, 刘鹏, 戴翚, 等. 加替沙星无菌检查方法的建立与标准操作探讨[J]. 药物分析杂志, 2007, 27(6): 877-880.
[23] 张新妹, 胡昌勤, 马越, 等. 敏感菌株在抗生素抑菌试验中的应用[J]. 广东药学院学报, 2003, 19(2): 116-119.
[24] 张新妹, 马越, 胡昌勤, 等. 抗菌药物无菌检查法中阳性对照菌选择的探讨[J]. 中国药事, 2003, 17(8): 513-515.
[25] Mcguire J, Kupiec T. Quality-control analytical methods:the quality of sterility testing[J]. Int J Pharm Compd, 2007,11(1): 52-55.
[26] 国家药典委员会. 关于1101无菌检查法标准草案的公示[S/OL]. (2023-9-13)[2024-1-12]. https://www.chp.org.cn/#/business/standard.
[27] 宋光艳, 冯震, 潘盈盈, 等. 流式细胞技术在药品无菌检查中的应用研究[J]. 中国药师, 2018, 21(2): 342-345.
[28] Mohr H, Lambrecht B, Bayer A, et al. Basics of flowcytometry-based sterility testing of platelet concentrates[J].Transfusion, 2006, 46(1): 41-49.
[29] 厉高慜, 潘伟婧, 王灿, 等. 二氧化碳信号检测的快速微生物方法应用于细胞制品无菌检查的评估[J]. 药物分析杂志, 2022, 42(1): 147-155.
[30] Bugno A, Saes D P S, Almodovar A A B, et al. Performancesurvey and comparison between rapid sterility testingmethod and pharmacopoeia sterility test[J]. J Pharm Innov,2018, 13(1): 27-35.
[31] Guest M, Pickard B, Smith B, et al. The use of amplifiedATP bioluminescence for rapid sterility testing of drugproduct formulations [J]. PDA J Pharm Sci Technol, 2023,77(5): 402-411.
[32] Brueckner D, Krahenbuhl S, Zuber U, et al. An alternativesterility assessment for parenteral drug products usingisothermal microcalorimetry[J]. J Appl Microbiol, 2017,123(3): 773-779.
[33] Petr J, Jiang C, Sevcik J, et al. Sterility testing by capillaryelectrophoresis: A comparison of online preconcentrationapproaches in capillaries with greater internal diameters[J].Electrophoresis, 2009, 30(22): 3870-3876.
[34] The United States Pharmacopeial Convention. UnitedStates Pharmacopoeia43-National formulary38[S]. (2020).Boston: United States Pharmacopoeia, 2020: 1211 Sterilityassurance.
[35] Daniell E, Bryans T, Darnell K, et al. Product SterilityTesting... To Test or Not to Test? That Is the Question[J].Biomed Instrum Technol, 2016, 50(Suppl 3): 35-43.
[36] 蓝福胜, 郑挺, 王晓英, 等. 盐酸莫西沙星氯化钠注射液无菌检查方法优化[J]. 海峡药学, 2023, 35(7): 48-51.
[37] 王君, 吴俊红, 黄加秀, 等. β-环糊精溶液在注射用德拉沙星无菌检查中的应用[J]. 中国药品标准, 2022, 23(6): 653-656.
[38] 李昊, 李旭, 张亚杰. 注射用甲磺酸培氟沙星无菌检查法的确定[J]. 中国抗生素杂志, 2017, 42(6): 531-533.
[39] 于翾, 曹晓云. 盐酸环丙沙星乳膏无菌检查方法的建立[J]. 天津药学, 2013, 25(3): 3-6.
[40] 湛文青, 林丽英. 氧氟沙星眼膏无菌检查方法的建立[J].今日药学, 2009, 19(9): 35-36.
[41] 江志杰, 刘文杰, 高春, 等. 左氧氟沙星注射液无菌检查方法验证[J]. 中国药品标准, 2008, 9(4): 245-247.
[42] 张新妹, 李会轻, 胡昌勤, 等. 5种抗生素滴眼剂的无菌检查[J]. 华西药学杂志, 2003, 18(5): 380-381.
[43] 孙春艳, 张春瑛, 沈佳特, 等. 注射用头孢菌素无菌检查的方法学验证[J]. 医药导报, 2007, 26(9): 1089-1091.
[44] 陈扣宝, 吕小燕. 注射用头孢噻肟钠舒巴坦钠无菌检查方法适用性研究[J]. 职业与健康, 2020, 36(13): 1757-1760.
[45] 肖莉. 注射用头孢曲松钠无菌检查法验证[J]. 中国药师,2011, 14(11): 1698-1700.
[46] 李趣嫦, 李文靖. 头孢匹胺无菌检查方法的建立[J]. 中国抗生素杂志, 2020, 45(12): 1242-1245.
[47] 张新妹, 刘元瑞, 胡昌勤, 等. 头孢地尼原料无菌检查法的研究[J]. 医药导报, 2004, 23(2): 121-122.
[48] 傅莉萍, 王朝丽, 李婷, 等. 氨曲南及其注射剂无菌检查方法适用性试验[J]. 药学服务与研究, 2021, 21(6): 419-423.
[49] 张平, 彭春丹, 王健美, 等. 美罗培南及其注射剂无菌检查方法的优化[J]. 中国药品标准, 2021, 22(5): 458-464.
[50] 张晓明, 何晓英. 青霉素粉针剂无菌检查方法的实验研究[J]. 中国抗生素杂志, 2004, 29(4): 255-256.
[51] 邵翠翠, 马弋, 邓瑜. 3种抗菌药物眼用制剂无菌检查方法的建立[J]. 医药导报, 2015, 34(z1): 110-111.
[52] 杨光梅, 管茂东, 黄燕, 等. 氯霉素无菌检查方法学研究[J]. 药物生物技术, 2023, 30(2): 136-139.
[53] 董自艳, 戴翚. 氯霉素滴眼液无菌检查方法的研究[J]. 中国实用医药, 2015, (16): 280-281.
[54] 李冰, 周曼迪, 傅蓉, 等. 利福霉素钠制剂的无菌检查法方法学研究[J]. 中国药师, 2014, 17(6): 1047-1049.
[55] 李秋菲, 杨敏, 赵生奇, 等. 注射用阿奇霉素无菌检查法方法学研究[J]. 中国药业, 2008, 17(20): 23-24.
[56] 殷飞, 吕玉奇, 崔春英. 抗生素品种无菌检查最佳冲洗条件的选择[J]. 中国药品标准, 2001, 2(4): 55-57.
[57] 夏天, 崔迎, 李宏铎, 等. 甲硝唑氯化钠注射液无菌检查方法适用性试验[J]. 中国医药导报, 2018, 15(24): 121-124.
[58] 裴小龙, 杨晓莉, 张志芸. 硝基咪唑类药物无菌检查中吐温80应用的研究[J]. 安徽医药, 2013, 17(4): 571-572.
[59] 刘洪祥, 刘海玲, 解慧, 等. 注射用替加环素无菌检查的研究及优化[J]. 药物分析杂志, 2020, 40(8): 1443-1450.
[60] 肖甜甜, 姜儒, 刘知源, 等. 注射用盐酸多西环素无菌检查方法学考察[J]. 中国药师, 2019, 22(1): 191-193.
[61] 张建革, 杨淑先, 刘守志. 多柔比星脂质体冻干粉针无菌检查方法探讨[J]. 医药导报, 2004, 23(4): 263.
本文作者王静、王振波、戴翚、肖璜、王似锦、周发友、马仕洪,中国食品药品检定研究院、宁夏回族自治区药品检验研究院,来源于中国抗生素杂志,仅供交流学习。

来源:Internet


