您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-26 14:03
前言
在过去的十年里,血流导向装置(FDs)已成为治疗颅内动脉瘤的标准血管内手术方法。FDs已经在临床中展现出卓越的安全性和动脉瘤闭塞率。因此,一些FDs已获得市场批准,还有更多的器械正在研发中。虽然FDs的临床性能特征对临床医生来说已经很熟悉,但对工程师如何实现成功的器械性能却了解较少。本文将概述工程师可用的基本FD设计参数,并描述对于实践中的介入医生而言,它们的选择如何影响器械性能的特性。
理想的FD
”血流导向装置“这个通用术语描述了覆盖动脉瘤/载瘤动脉交界的装置,以实现动脉瘤闭塞。在放置后最初阶段,该装置可能会导致一定程度的血流“转移”到载瘤动脉中,这些血流原本可能会进入动脉瘤,而且这个术语本身并不具体,可能并不比”扰流“等术语更有效。
然而,随着时间的推移,组织将会生长在动脉瘤颈部,动脉瘤将会闭塞,最终的目标是将所有的血流都从动脉瘤囊中转移开。此外,现在有腔内和囊内两种血流导向装置;本文将专注于前者类型。
一般来说,血流导向装置(FDs)是编织或织造的支架,释放至动脉瘤颈部处的载瘤动脉中。这些装置的目的是转移大部分流经动脉瘤的血液,导致动脉瘤内血液停滞并凝结。这种血流转移导致的动脉瘤内血液滞留在理论上形成了动脉瘤腔内的血栓栓塞,阻碍了血流进入动脉瘤。同时,该装置作为内皮化和新内膜生长在动脉瘤颈部的脚手架,最终将动脉瘤从血流中闭塞。总的来说,理想的FD最大程度地简化了植入过程和提高动脉瘤闭塞,同时最小化并发症的风险。
多个相互关联的FD性能特征有助于临床疗效。理想的FD最大程度地促进动脉瘤囊内的血液滞留,同时促进动脉瘤颈部的快速内皮化和新内膜生长。主要设计目标简要列举如下,然后在下文中详细讨论与设计选择相关的工程原理。首先,FD与载瘤动脉的完美贴壁在释放后有利于囊内血液滞留和内皮化。此外,FD的紧密贴壁可以减少装置编织丝与动脉壁之间形成血栓的风险,但这可能导致穿支动脉的堵塞和狭窄。提高装置的灵活性和在某些情况下增加装置的径向张开力(或慢性外扩力)可以实现更好的贴壁。在笔直的血管中,增加张开力理论上会将编织丝更紧贴在血管壁上。然而,在迂曲的解剖结构中,装置的灵活性可能比径向张开力更有利于保持贴壁。因此,贴壁最终是多种因素的结果。其次,理想的FD最小化了在腔内引起血栓栓塞或邻近动脉瘤处穿支动脉闭塞等并发症的风险。第三,理想的FD简化了介入医生的操作释放过程。
可以通过较小内径(ID)微导管释放的FD对于推送微导管穿过迂曲的脑血管系统是有优势的,并且可能允许将其推送至更远处的动脉瘤。目前FD输送微导管的基准内径为0.027英寸,理想的FD应该可以通过这个尺寸或更小的微导管进行输送释放。减少输送力(我们定义为推送FD通过微导管腔道所需的力)也有助于简化介入医生的操作输送过程。理想的FD应该尽可能轻松地实现适当的贴壁。最后,FD需要具有适当的可视性,以便在透视引导下进行输送,而不会影响其MR成像安全性或诱导过多的CT或MR成像伪影,这可能会妨碍无创随访成像。
FD设计参数
通常情况下,血流导向装置(FDs)是通过在芯轴周围编织一组36-96根金属丝,并对其进行热处理以锁定形状而制成的。然后移除芯轴,留下金属网状管,再将其切割成所需长度。器械随后可能会进一步加工,包括固定松散的金属丝端部、添加放射性显影标记,或处理器械表面。最后,将器械装入其输送系统中。尽管FDs的总体构造在概念上很简单,但涉及许多设计参数,包括金属丝直径、编织中的金属丝数量、金属丝材料的选择等,所有这些都会影响器械性能。选择其中一个设计参数可能会对FD的一个性能特征产生积极影响,同时对另一个性能特征产生负面影响。FD工程师的任务是选择参数,找到一个平衡点,以优化介入医生认为最重要的性能特征。FD设计参数与性能影响之间的关系总结在图1中。
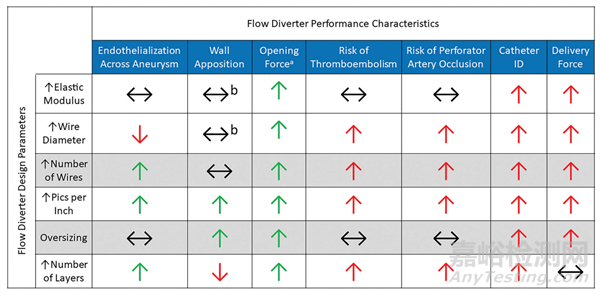
图1. FD设计参数与结果性能特征之间的关系。绿色和红色箭头分别表示在器械性能和安全性方面的有益或有害关系。黑色水平箭头表示设计参数与性能特征之间的独立或多因素关系。A,优化的张开力假设编织的金属丝在被压缩到微导管后不会发生塑性变形,从而实现器械完全再扩张。B,贴壁是复杂的,取决于许多变量,包括载瘤血管的迂曲程度。
FD编织几何构造
工程师可以调整许多FD编织几何设计参数。首先是编织内单根金属丝的直径。增加金属丝直径会增加器械的整体强度,提高张开力和径向抗压能力。然而,这种改善的张开力是以增加输送力为代价的,并且可能需要更大的微导管内径进行输送。较大的金属丝直径可能与延迟的内皮化以及血栓栓塞的风险相关,就像较大的冠状支架支柱一样。然而,这种关系在FD应用中尚未得到广泛研究。市场批准的FD通常具有约18-35μm(约0.0007-0.001英寸)范围内的金属丝直径。
另一个设计参数是编织内的金属丝数量。与金属丝直径类似,增加编织内的金属丝数量将增加FD的张开力,但会增加输送力,可能需要更大的微导管内径。例如,Pipeline Vantage(Medtronic)较大直径的产品包含64根金属丝,通过0.027英寸内径微导管释放,而较小直径的产品包含48根金属丝,可以通过0.021英寸内径微导管释放。在编织内增加更多金属丝已被证明有助于促进动脉瘤颈部的内皮化。然而,更多的金属丝也可能与更大的穿支动脉闭塞风险和血栓栓塞相关。市场批准的FD通常包含48-64根金属丝。另一个类似的FD设计参数是pics-per-inch(PPI),它定义为沿器械长度每英寸的金属丝交叉目数。通过增加编织内的金属丝数量可以增加PPI,也可以通过改变编织金属丝的角度来调整,如图2所示。当从纵向视图观察FD时,如果将编织角定义为金属丝与支架轴线之间的角度(如图2所定义),增加编织角度会增加PPI。更高的PPI会导致FD具有更大的张开力,并可以改善器械顺应性,最终实现更好的贴壁。然而,与增加PPI相关的金属丝密度增加可能也会增加输送力,并需要更大内径的微导管。与增加编织内的金属丝数量类似,更高的PPI有助于动脉瘤闭塞和动脉瘤颈部的内皮化,但可能增加穿支动脉闭塞和血栓栓塞的风险。
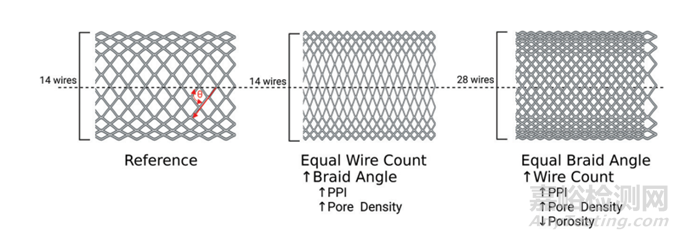
图2. 纤维角度(由红色θ定义)与金属丝或PPI以及孔密度之间的关系的图示。
FD的oversize是在选择器械时介入医生可以考虑的另一个设计参数或选项。器械可能被构造成其公称直径(由编织金属丝的芯轴直径决定)大于其预期载瘤动脉直径。最初,oversize的动机是为了提高贴壁和张开力。然而,体外流体动力学研究表明,oversize会导致器械几何形状的改变,如金属丝之间的角度或网孔大小,从而导致动脉瘤囊内的血流增加。因此,oversize与临床上较低的动脉瘤闭塞率相关。在选择FD尺寸时还需要考虑器械的缩短问题。在径向方向上过度扩张的FD将最终变得更短。相反,当在比器械直径小得多的动脉中释放时,FD将比预期更长。
在构建FD时,也可以使用多层金属丝编织。理论上增加层数会增加张开力,但可能需要更大的微导管内径。增加层数的主要动机是通过在动脉瘤颈上沉积更多的金属丝来“人为”增加PPI,并由此提高血流导向功能。多层可能导致动脉瘤囊内的血液滞留增加,以及器械和动脉瘤颈上更快的组织生长。然而,堆叠的金属丝会增加它们载瘤血管的内腔的延伸,加剧血栓栓塞的风险,以及金属丝与动脉壁贴合后内皮化的速率。此外,额外的层数可能会导致层间位移或者通过额外的装置释放对内皮细胞造成更多的破坏。Flow-Redirection Endoluminal Device (FRED)(MicroVention)具有独特设计,外部采用较大的金属丝编织,类似于LVIS支架(MicroVention),内部采用编织FD。相关的是,使用多个单层装置在动脉瘤颈部套叠式释放也被证明增加血栓栓塞并发症的发生率。
孔隙度、孔密度和金属覆盖率是经典的FD指标,最终是其选定的设计参数的结果。孔隙度定义为器械壁面未被金属丝覆盖的百分比区域。相反,金属覆盖率定义为器械壁面被金属丝覆盖的百分比区域;两者不够具体,因为更粗的金属丝或更高的金属丝密度可能导致更高的金属覆盖率或更低的孔隙度。孔密度定义为每个面积内FD壁内的开放单元或孔的数量,并且更具体。这些特征将决定器械如何将血流从动脉瘤中导流出去并让其在里面停滞。增加编织内的金属丝数量、PPI和层数将减少孔隙度,并增加孔密度和金属覆盖率。另一个考虑因素是载瘤血管的曲率。对于给定的器械,在弯曲段中释放时,器械靠近曲线外缘的区域的孔隙度将更大。市场批准的FD的孔隙度和孔密度通常在50%–70%和13–30 pores/mm2范围内。
材料选择
由于各种通常相互关联的结构性质,选择用于构建编织丝的材料对FD的整体性能有显着影响。举例说明,考虑一种在FD设计中关键的材料特性:弹性模量(也称为杨氏模量),它衡量材料单位应变下对弹性变形的抵抗程度,或者简单地被视为弹性刚度。弹性模量与整体器械刚度和性能的关系并不直接,因为存在其他影响因素。例如,结构刚度更多地取决于导丝直径和编织参数,而不仅仅是弹性模量。此外,其他现象,如局部屈服和弹性应变极限,可以根据边界条件大幅改变实际器械的响应。
具有较高弹性模量的材料在变形时需要更多的能量,但当它们恢复到原始形状时会释放更多的能量(可以想象成一根硬弹簧和一根软弹簧之间的区别)。相反,具有较高弹性模量的材料通常显示较低的弹性应变极限,这可能会降低尺寸恢复能力,或者说是器械在被压入导管后能够重新膨胀的直径。因此,具有较高弹性模量的编织丝组成的FD可能会表现出更高的张开力或在贴壁之前由于尺寸恢复不足而失去力,并且可能需要更大内径的微导管来进行补偿。钴-镍-铬合金已经被优化来增加弹性模量,因此通常被选择作为FD材料。PipelineEmbolization Device(PED;Medtronic)和Surpass Evolve(Stryker)主要由钴合金丝组成。
另一个关键的材料特性是弹性应变极限,它定义为材料在经历永久形状改变之前可以被变形的程度。在FD应用中,较高的弹性应变极限允许器械被压缩到更小的直径,并可以围绕更弯曲的曲线进行弯曲,同时仍保持自我扩张到原始释放形状的能力。这一特性对于导航到更远端动脉瘤尤其有利,因为那里的载瘤动脉直径更小,迂曲度更大。镍钛合金已经被优化以通过相变和相关的超弹性来增加弹性应变极限,因此也是常用的FD导丝材料。FRED和p64(phenox)主要由镍钛丝组成。
钴-镍-铬和镍钛代表了基于它们的机械性能而选择的优秀材料,但它们的不透射线度较低。相对高不透射线密度的材料,如钽、铂或铂-钨合金,被用于提供比钴-镍-铬或镍钛等材料更好的显影性,以帮助在透视引导下进行输送。所有市场批准的FD都在其结构中加入了某种不透射线元素。例如,PED和Surpass Evolve在它们的编织中采用了铂-钨丝,而FRED则在器械的两端附有钽标记,并在层之间采用统一的钽丝。传递不透射线性的另一种方法是使用DFT丝。DFT丝包含一个内芯丝,通常由不透射线的铂或钽组成,外层包裹着镍钛或钴-镍-铬合金。由DFT丝构建的FD旨在在整个器械长度范围内提供均匀的不透射线性,同时利用镍钛或钴-镍-铬合金的优势机械性能。Silk Vista Baby(Balt)和DERIVO FD(Acandis)是采用镍钛外层/铂内芯DFT丝构建的CE批准FD的示例。Pipeline Vantage则采用了钴合金外层/铂内芯DFT丝。表1和表2总结了材料特性以及由传统FD材料构建的市场批准FD的示例。

表1. 市场批准FD中使用的基材的性能。a:在应用建模值时要适当考虑杨氏模量和弹性极限(对于镍钛来说是伪弹性)可能会因工艺结构、纹理和强度结果而有很大差异。这里给出的是现实的可能结果,取决于供应商的生产路径和目标结果。
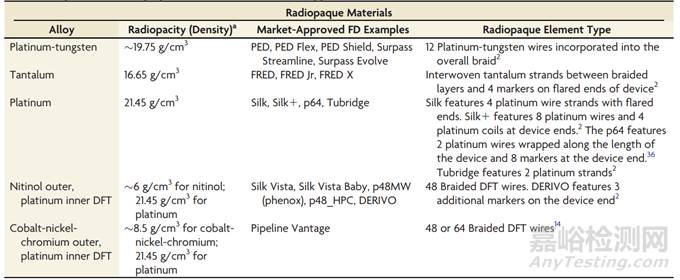
表2. 市场批准的FD中使用的不透射线材料的特性。通过一致的方法,密度是作为不透射线度的粗略代理,以代替缺乏这些材料和几何形状的确证数据。未来的研究,超出了目前的范围,可能会侧重于作为材料、几何形状、过滤材料和成像参数的函数进行定量辐射透视性比较。这样的研究可以用来辅助未来器械的设计。
表面修饰
对FD的表面进行改性是改善器械性能的另一种方法。导丝的表面可以通过电、化学或机械方式进行改变或涂层,以产生有益效果。表面改性旨在减少血栓形成、增加内皮化和/或作为润滑剂以减少输送力。一些市场批准的FD具有特定的表面改性,旨在提高临床疗效,而FD表面改性仍然是研究的热点话题。PED的新版本采用了Shield Technology(Medtronic),这是一种沉积在编织丝表面上的磷脂胆碱层,旨在减少血栓形成和增加内皮化。体外研究表明相对于未涂层的PED,其血栓形成能力降低。体内研究表明由于涂层,血栓形成能力降低,内皮化速度更快。DERIVO FD编织丝经过处理形成表面氧化物和氧氮化物,称为BlueXide,旨在减少摩擦/输送力和血栓形成能力。FRED的新版本FRED X采用了聚(2-甲氧基乙基丙烯酸酯)涂层,已被证实在体外可减少血栓形成能力。p48的新版本p48_HPC(phenox)采用了抗血栓形成的糖基亲水涂层,在接受单一抗血小板治疗的5例未破裂动脉瘤患者中显示出了有前景的结果。
未来方向
随着FD的临床应用日益普及,对FD技术进行研究和开发的强度也日益增加。日益增长的临床FD性能数据可用于设计下一代器械。计算血流动力学方法正在被应用于更好地理解囊状血液淤积和动脉瘤闭塞的最佳FD设计参数。活性表面涂层正在被设计出来以赋予治疗效果。例如,释放一氧化氮的涂层在减少血栓形成和增加血管支架内皮化方面表现出潜力。肝素或其他含抗凝剂的涂层也可能减少血栓形成。蛋白质可以附着到器械表面,以促进内皮细胞的捕获和增殖。可生物降解的FD也在研发之中。这些器件旨在在治愈动脉瘤后溶解,减轻或消除与常规FD永久存在相关的并发症。
总结
大多数介入医生对血流导向装置(FD)的性能理解是基于他们的临床经验。FD的选择可能与个人偏好以及特定医疗中心可获得的FD有关。此外,某些器械仅在特定地理区域获得了市场批准。例如,PED、Surpass和FRED是目前在美国可用的三种FD;Silk、p64和DERIVO来自获得CE批准的欧洲公司,而Tubridge(MicroPort)在中国获得了国家药品监督管理局的批准。地理可用性影响了特定地区某些器械的受欢迎程度。每种FD都具有独特的设计,因此具有自己一套优点和缺点。对工程设计原则和临床性能之间关系的更全面理解可能有助于介入医生在不断增长的FD市场中不断前行。此外,我们相信这种提高的理解可以促进临床医生和工程师之间的合作,最终加速FD技术的发展。

来源:TRA of Neuro


