您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-25 10:28
摘 要 Abstract
参考区间是定量体外诊断试剂性能的关键参数,也是体外诊断试剂注册审评的重要关注点。2022 年9 月,国家药品监督管理局医疗器械技术审评中心发布《体外诊断试剂参考区间确定注册审查指导原则》,作为专门针对体外诊断试剂参考区间监管的指导文件,其为提升体外诊断试剂的准确性和可靠性提供了保障,也对行业产生了积极影响。本文通过对监管部门、相关企业及医学实验室进行访谈,并结合相关文献和数据,对我国体外诊断试剂参考区间的监管现状和问题进行分析。在借鉴国际经验的基础上,提出优化体外诊断试剂参考区间监管的几点思考,包括实施分类管理、允许特殊产品上市后补充数据、允许部分产品同步开展参考区间研究和临床评价、推动参考区间行业标准建立及建立多元合作机制等,以期为完善体外诊断试剂的监管体系提供参考。
Reference intervals are critical parameters for the performance of quantitative in vitro diagnostic reagents and an important focus in the registration and evaluation of these reagents. In September 2022, the Center for Medical Device Evaluation of the National Medical Products Administration in Chian issued the Guiding Principles for the Establishment of Reference Intervals for In Vitro Diagnostics in Registration Review, the first guidance document specifically addressing the regulation of reference intervals for in vitro diagnostic reagents. This document aims to enhance the accuracy and reliability of in vitro diagnostic reagents and has significant impact on the industry. This article analyzes the current situation and existing issues of reference interval regulation in China through literature review, data analysis, and interviews with regulatory authorities, related enterprises, and medical laboratories. Based on international experiences, we propose several recommendations for improving the regulation of reference intervals for in vitro diagnostics in China, including implementing classification management, balancing regulatory efforts across the regulation cycle, allowing the synchronicity of reference interval studies and clinical evaluations, promoting the establishment of industrial standards, and establishing multicollaboration mechanisms. These suggestions aim to provide insights for improving the regulatory framework of in vitro diagnostic reagents in China.
关键词 Key words
体外诊断试剂;参考区间;注册审查;行业标准;监管建议
in vitro diagnostics; reference intervals; registration review; industry standards; regulatory suggestions
体外诊断(in vitro diagnosis,IVD)试剂,是指在人体之外,通过对人体样本(血液、体液、组织等)进行检测获取临床诊断信息,进而判断疾病或机体功能的试剂、试剂盒、校准品、质控品等产品[1]。IVD 日益成为人类疾病预防、诊断、治疗的重要组成部分,据统计,约80% 的临床诊断信息来自IVD,但其费用仅占医疗费用的20%[2]。参考区间是定量IVD 试剂性能的关键参数, 也是IVD 试剂注册审评的重要关注点。国际上IVD 试剂参考区间的确定通常参考美国临床和实验室标准化协会(The Clinical and Laboratory Standards Institute,CLSI) 制定的EP28-A3c《临床实验室中参考区间的定义、建立和验证》(Defining, Establishing, and Verifying Reference Intervals in the Clinical Laboratory) 指南, 我国也以此为指导标准,制定了WS/T 402-2012《临床实验室检验项目参考区间的制定》。为了完善IVD 试剂注册与备案管理,2022年9 月,国家药品监督管理局医疗器械技术审评中心(以下简称器审中心)发布了《体外诊断试剂参考区间确定注册审查指导原则》(以下简称《指导原则》),对参考区间注册审查的基本原则、技术审查要点等做出了规定。《指导原则》规范了IVD 试剂参考区间确定的方法与程序,为提升IVD 试剂参考区间的准确性、可靠性和科学性提供了保障。作为一部专门针对IVD 试剂参考区间审查的指导文件,其对于IVD 试剂产品的注册具有重大意义。为了解当前IVD 试剂参考区间的监管现状,本文通过对监管部门、相关企业、用户(医学实验室)等进行访谈调研,结合文献研究,分析现有政策的影响及问题,并提出进一步优化IVD 试剂参考区间监管的建议,以期为监管部门的科学决策提供参考,推动IVD试剂监管体系不断完善。
1、 我国IVD 试剂参考区间确定的注册审查现状
1.1 IVD 试剂注册与备案的主要环节
根据《体外诊断试剂注册与备案管理办法》,首次注册的第二类、第三类IVD 试剂,一般需要进行产品研制、临床评价、注册体系核查、产品注册等环节,如图1 所示[1]。在IVD 试剂产品研制阶段,注册申请人根据产品用途和技术特征进行IVD 试剂非临床研究,其中建立和确认定量IVD 试剂的参考区间是关键环节之一。IVD 试剂的临床评价主要是采用科学、合理的方法,对临床数据进行分析和评价,从而证明试剂的安全性和有效性。根据《免于临床试验的体外诊断试剂临床评价技术指导原则》[3] 和《体外诊断试剂临床试验技术指导原则》[4],企业在开展临床评价或临床试验之前,必须确保产品已经定型,包括已完成IVD 试剂的阳性判断值或参考区间研究。这就要求IVD 试剂参考区间的确定工作必须在进入临床评价阶段之前完成,二者存在先后顺序。
1.2 IVD 试剂参考区间确定注册审查的主要规定
1.2.1 IVD 试剂参考区间的研究资料要求
在我国IVD 试剂注册过程中,生产企业需提交产品研制阶段获得的有关阳性判断值或参考区间的研究资料。根据《体外诊断试剂说明书编写指导原则》[5],产品说明书中应明确阳性判断值或参考区间,并简要说明其确定方法。根据《体外诊断试剂注册申报资料要求及说明》[6] 的要求,申请人在阳性判断值或参考区间研究中需详细说明确定方法、依据、样本来源与组成,并提交相关研究资料。
1.2.2 IVD 试剂参考区间确定的基本原则
《指导原则》对于IVD 试剂参考区间确定方式的基本原则做出了规定,这是一项重要变化。《指导原则》要求针对首次在国内注册的进口产品,如果产品在申请人注册地或生产地所在国家和地区已批准上市,申请人需验证申报产品说明书中的参考区间是否适用,如验证不通过,则需建立适用于我国人群的参考区间。针对创新医疗器械,如果未在申请人注册地或生产地所在国家和地区上市,需要建立包含我国人群的参考区间。即首次注册的进口注册产品,无论其是否在境外已批准上市,都需要提供适用于我国人群的参考区间,这与之前进口注册产品可以提交产品研发阶段确定的境外人群参考区间的规定相比发生了较大的变化。对于境内注册产品,《指导原则》对于参考区间确定的要求变化较小。
1.2.3 IVD 试剂参考区间确定的技术审查要点
《指导原则》中IVD 试剂参考区间建立的技术审查要点包括参考样本组的选择、样本采集与处理、样本检测、数据分析等,与WS/T 402-2012《临床实验室检验项目参考区间的制定》相关标准基本一致。在参考样本数量方面,《指导原则》提出参考区间的建立研究至少需要120 例参考样本,可对参考限的90% 置信区间进行准确估计。如进行分组评估,每组还需满足相应置信区间的参考样本量要求。
对于参考区间的验证,《指导原则》提出进行验证需满足原始参考区间研究可信度高、检测系统具有可比性、参考区间研究的分析前因素具有可比性、参考人群的适宜性等4 个条件。如果无法同时满足上述条件,申请人应建立参考区间。在参考样本数量方面建议选择至少20 例与申报产品预期使用人群地理分布和人口统计学特征相似的参考个体。
1.2.4 关于人类遗传资源的管理要求
由于IVD 试剂参考区间研究需获取临床样本才能开展,因此需要遵守我国关于人类遗传资源管理相关法规的规定。根据《人类遗传资源管理条例》[7] 和《人类遗传资源管理条例实施细则》[8],进口企业在临床机构使用我国人类遗传资源进行国际合作的临床试验时,如果不涉及人类遗传资源材料的出境,合作双方在开始临床试验前需向国务院主管部门申请国际合作行政许可或国际合作临床试验备案。在我国境内从事的中国人类遗传资源采集活动,若涉及重要遗传家系、特定地区人类遗传资源或人数大于3000例时,则需要我国人类遗传资源采集行政许可。
2、《指导原则》的影响分析
《指导原则》的发布进一步规范了IVD 试剂注册与备案流程,有利于保障IVD 试剂的安全性和有效性。虽然《指导原则》中明确指出:“本指导原则是供注册申请人和技术审评人员使用的指导文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。”但实际工作中,因为《指导原则》出自监管部门,对于注册申请人仍然具有一定的规范性和约束力。笔者对监管部门工作人员、相关企业(进口及国产企业)管理者和医学实验室(医院检验科)临床专家等不同类型进行了半结构化访谈,主要围绕《指导原则》发布对行业的影响、当前我国IVD 试剂注册审批过程中的问题及解决思路等进行调研,并综合相关数据的分析情况,剖析了《指导原则》的发布对IVD 试剂参考区间确定带来的益处与问题。
2.1 提升IVD 试剂的准确性,促进行业规范发展
《指导原则》要求进口IVD产品需进行我国人群参考区间的建立或验证,以保障IVD 试剂的准确性和有效性。调研中,部分临床检验专家认为,《指导原则》对于参考区间确定基本原则及技术审查要点的规定可以提高IVD在我国人群中诊断结果的准确性,降低误诊和漏诊的风险,保护患者的权益和安全,促进IVD 行业发展更加规范。《指导原则》对IVD 产品参考区间的技术要求和质量标准的进一步明确,可促进相关企业加大研发力度,提升产品的安全性和可靠性。此外,还可推动我国IVD 行业向更规范、创新和国际化的方向发展,为患者提供优质、可靠的IVD 产品。
2.2 增加企业注册成本
《指导原则》提出的进口IVD 产品需进行我国人群参考区间的建立或验证要求,可能会增加相关企业的注册成本。对于进口申报产品,除创新产品之外,大部分已在其原产国(地区)产品研制过程中进行了包括参考区间建立在内的相关研究工作。但通常参考人群以本国和地区人群为主,按照《指导原则》要求,进口IVD 企业在注册递交资料前需要在我国境内再进行一次参考区间的研究(通常是建立),这对于进口IVD 产品企业来说是一个重复研究过程,增加了企业的注册成本,也延长了注册时间。根据调研可知,单独进行的一个新的参考区间研究项目,通常需经过伦理资料递交批准、研究协议签署、人类遗传资源国际合作临床试验备案或国际合作行政许可等程序,除了研究经费投入,时间方面总体至少需要5~6 个月,增加了企业注册的时间和经济等成本。
2.3 影响创新IVD 产品同步上市
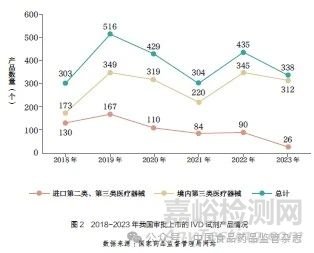
《指导原则》的发布提高了进口IVD 产品注册门槛,延长了注册时间,进一步可能会影响创新IVD 产品的同步上市。本文基于国家药品监督管理局网站相关信息, 对2018~2023 年我国审批上市的IVD 试剂产品(境内第三类医疗器械、进口第二类和第三类医疗器械)进行了统计,如图2 所示。2018~2023 年我国共审批上市IVD 试剂产品2325 个。从变化趋势来看,2019 年后我国通过审批上市的IVD 产品数量总体呈下降趋势,其中境内第三类医疗器械获批数量在2021 年下降后,于2022 年再次明显上升。然而获得审批的进口第二类和第三类医疗器械数量在2021 年后仍然呈下降趋势,可能与《指导原则》的发布实施有一定的关联。从使用终端和患者获益的角度看,相关产品获批数量减少可能会影响患者及时获取较高临床价值的创新IVD 产品,与国家提倡的尽快引入先进产品、鼓励全球同步上市的目标尚存在差距。
3、 我国IVD 试剂参考区间的监管措施及配套政策存在不足
通过调研了解到我国在IVD试剂参考区间监管措施及配套政策等方面尚存在不足,对这些问题的解决或优化将有助于降低IVD 参考区间的监管成本。
3.1 审查要求缺乏差异化
《指导原则》提出所有新注册IVD 产品均需提交我国人群参考区间,笔者认为对于经过充分验证的成熟临床检验项目可能并不是必要的。部分较为成熟的检测项目在临床诊断中可能更多以医学决定水平(medical decision level,MDL)作为诊断依据,例如葡萄糖检测,其能够快速准确地测量血液或尿液中的葡萄糖含量。这类检测项目,通常不需要再建立参考区间,而是直接提供临床诊断所需的切点,协助疾病的准确诊断。因此,对于IVD 试剂参考区间的审查,建议采取差异化原则,优化审查要求,进一步明确需要建立参考区间的品种。
3.2 监管机制灵活度不足
IVD 试剂虽然是临床诊断的重要辅助,但通常不与人体直接接触,从健康风险的角度来看属于较低风险的医疗器械。对这类产品的监管应在保证一定安全有效性的基础上,尽量减少上市前对企业产品注册造成负担,并注重上市后的动态监管。笔者认为可以创新监管机制,在部分进口企业专门开展我国人群IVD 试剂参考区间研究合规成本较高的情况下,考虑采取更为灵活的监管机制,允许企业采取上市后补交我国人群参考区间信息的方式完成注册的相关要求。
3.3 存在重复投入情况
《指导原则》中关于IVD 试剂参考区间的建立最低需120 例参考样本的要求虽然是国际通用标准,但对于我国,由于人口基数、地区、民族等差异,该参考样本数量要求可能偏少,不能满足监管部门对于IVD 试剂准确性及有效性的要求。然而,为了满足《指导原则》对于参考区间确立的基本要求,注册申请企业仍需单独组织小样本的参考区间研究项目,且每个研究项目都需投入较多的时间、人力和物力资源。再者,根据GB/T 22576.1-2018《医学实验室 质量和能力的要求 第1部分:通用要求》对医学实验室的要求,作为使用方的医学实验室在IVD 新产品引进时也需要进行参考区间的验证或建立工作[9],其建立、验证要求与相关法规对产品上市前的要求基本相同。除此之外,企业在临床评价阶段,要按照与参考区间研究同样的前期流程组织临床评价研究,两个阶段存在严格的先后顺序,不能为了缩短时间、压缩成本而同时进行。因此,从整体看,在目前的制度安排下,对IVD 参考区间的研究投入存在重复和资源浪费的问题。
3.4 缺乏行业标准
《指导原则》提出:“已经有国内公认、统一的参考区间和医学决定水平的检测项目,可不再建立参考区间,此类产品应将评估重点放在标准化方面。”其中“国内公认、统一的参考区间”主要指建立了行业标准的检验项目参考区间。“十二五”期间,科技部立项开展了“中国人群常用临床检验项目参考区间及相关技术支撑体系的建立”重大专项课题,推进常规临床检验项目参考区间行业标准的研究制定。在此基础上,2012 年,原国家卫生部发布了首个临床常用检验项目参考区间的行业标准,即WS/T404-2012《临床常用生化检验项目参考区间》。截至目前,该行业标准已发布了10 个部分,覆盖了33 个临床检验项目,另外还包含了2 个儿童常规临床检验项目参考区间卫生行业标准(覆盖35 个检验项目)。但我国仍有约60% 的生化检验项目和约90% 的免疫检验项目尚无行业标准。对于这类产品,企业通常需要投入更多的成本来建立我国人群参考区间。
4、 IVD 试剂国际监管经验
美国、欧盟等国家和地区在IVD 试剂产品监管领域经验较为丰富,其监管体系具有一定的借鉴意义。本文对美国、欧盟等国家和地区IVD 试剂产品的监管措施进行了介绍,为我国完善相关监管措施提供参考。
4.1 最小负担原则
为了降低监管所带来的成本,美国食品药品监督管理局(Food and Drug Administration,FDA)提出了最小负担原则,其概念为用最少量的必要信息,在适当的时间、以最有效的方式,恰当地解决相关监管问题或事项[10]。核心思想是在保持质量标准不下降的前提下,合理配置监管资源,提升监管效率,减少不必要的监管负担,不延误有价值产品上市。这项原则适用于监管和企业双方的工作,例如对于监管方而言,“最少量的必要信息”可以体现为利用现有文献即可进行医疗器械的审批;“适当的时间”可以体现为“全生命周期监管”,即允许企业提供上市后数据用于解答FDA 的监管问题;“采用最有效的方法解决监管问题和事项” 在应用中体现为简化流程和要求,并在适当的时间范围内作出监管决策。
4.2 提供平稳衔接过渡期
2017 年, 欧盟发布了关于IVD 试剂监管的法规《体外诊断医疗器械条例》(In Vitro Diagnost ic Medical Devices Regulation,IVDR),引入与全球协调工作组(The Global Harmonization Task Force)相关指南中一致的体外诊断医疗器械风险分类系统[11],将医疗器械按照风险分为A、B、C 和D 4 类,随着医疗器械风险等级升高,其监管要求相应增加。为帮助企业灵活应对和熟悉IVDR 的有关规定,减少监管变化带来的上市投入成本增加,欧盟设置了5 年的“新旧”法规过渡期,企业筹备审评上市的产品可在过渡间尽快完成上市申请,IVDR 已于2022 年5 月26 日全面实施。
4.3 行业协会参与制定相关标准
美国IVD 试剂审评可以由政府及行业协会共同推动。行业协会集结IVD 领域的专家人才,例如CLSI 作为非营利行业组织,致力于推广基于行业共识的标准和指南,其影响力较大,已成为影响监管标准的重要利益相关方。2014 年FDA 网站收录了CLSI的 EP28-A3c 号文件作为IVD试剂参考区间标准指南,其中提出了对于胆固醇、糖化血红蛋白等检测物,其参考区间可由医学决定水平取代,临床实验室无需重新建立参考区间。
4.4 整合资源提升研究水平
CLSI 提出有必要建立一个国家和地区级的参考样本收集计划,并搭建参考区间研究的标本库。通过适当的财务支持、清晰的定义要求和大规模的样本群体,参考区间的质量将得到显著提高。这不仅有助于确保参考区间的科学可靠性,还能为临床实验室医学提供基于人口统计学和地理差异的可检测参考区间。同时,参考样本收集计划可以减少本地参考区间研究的重复成本,并防止使用不适当的参考区间导致的成本浪费。通过使用这些储存的样本,可以记录可靠的参考区间转移,从而提高数据的可追溯性和实用性。此外,积累符合行业共识和指南条件的参考区间研究数据,能够促使更多的实验室共享可信赖的参考区间数据,并搭建一个国家级数据库,有助于改善参考区间研究的质量和效率。
5、 关于优化我国IVD 试剂参考区间监管体系的思考
通过对利益相关方的调研分析并借鉴IVD 监管的国际经验,笔者建议可以以科学、高效、协同为原则,完善IVD 试剂参考区间监管措施及配套政策,促进行业高质量发展,实现以人民健康为中心的发展目标。
5.1 实施分类管理
在疾病诊疗过程中,IVD 试剂的检测结果需结合临床症状以及其他检测进行综合判断。因此,笔者建议对IVD 试剂进行参考区间分类管理从而实现监管体系优化,引导审评审批的稀缺资源进一步向创新产品、高风险产品倾斜。如前文所述,除参考区间以外,有部分检测项目使用MDL 作为临床中参考的限值。因此,建议相关部门可以组织权威临床及检验专家提出“参考区间豁免清单”,例如具备“检验项目参考区间行业标准”的项目和以医学决定水平作为临床诊断标准的检测项目所涉及的产品,“参考区间豁免清单”内产品在上市审批时可免于提交我国人群参考区间确立资料。
5.2 允许特殊产品上市后补充数据
上市前减少审批过程中额外的行政流程,对于非必要的材料采取上市后补充递交的形式,合理缩短审批周期,上市后通过监测、召回和监督检查等后期监管措施,保障IVD 试剂的质量和安全性。例如,对于涉及特殊人群(新生儿、儿童、孕妇、老年人等)参考区间的进口注册产品,这些人群的参考区间资料可采用上市后研究、真实世界证据等证据形式来递交。根据临床实际应用,认可证据多样性,实现动态监管。
5.3 允许成熟的IVD 试剂同步开展参考区间研究和临床评价
同步进行IVD 试剂参考区间研究和临床评价有利于缩短产品的研发周期。两项研究并行或交叉进行,企业可以更加高效地利用时间和资源,加速产品的研发进程。对于已经拥有行业标准参考区间或属于《免于临床试验的体外诊断试剂临床评价技术指导原则》中的IVD 试剂,可以进一步考虑给予企业更大的自主权。这类产品通常已经过市场的检验和认可,其安全性和有效性得到了广泛认证。因此,在审批过程中,可以适当简化或优化其参考区间研究和临床评价活动的要求,以便企业能够更加灵活地安排研发计划,提高市场竞争力。
5.4 大力推进行业标准的建立
建立临床检验项目参考区间卫生行业标准不仅对临床工作具有借鉴价值,有助于减轻相关企业产品研发和注册的负担,同时还能够促进IVD 试剂审批的效率和质量。因此,建议有关部门积极推动我国临床检验项目参考区间的科学研究,增加科研资金投入,并在此基础上,制定更多的参考区间行业标准,更好地满足行业发展需求。
5.5 建立多元合作机制,促进资源整合
建议在建立检验项目参考区间的过程中,通过强化政府、企业和社会各方资源的整合, 提高IVD 产品参考区间研究的效率和样本的代表性, 提升参考区间研究水平。主要可考虑以下2 种方式。
一是开放科研项目合作。目前,我国行业标准的制定主要由国家科研基金支持,由国家科技部门立项,并由检验专家负责全国多中心研究。为了筹集更多的资金支持临床检验项目参考区间研究,可以建立多元筹资机制,鼓励企业提供资金,共同建设科研基金以支持相关科研项目。这种合作机制有助于整合政府和社会资源,集中进行高水平的研究,避免了单一政府投入的资源不足和众多企业分散投入等问题,还能够显著提升我国在临床检验项目方面的科研水平。
二是共建公共实验室。根据国际经验,公共实验室不仅能够提供高水平研究成果,还可以为药械审评部门提供技术支持和服务,提高审评工作效率和质量。建议可以采用公私合作(public-private partnership) 模式, 共同建设非营利性质的IVD 参考区间研究公共实验室。在监管部门的认证下,该实验室可以由医学实验室、临床检验行业组织等多方参与。公共实验室依托医院招募样本,企业提供产品,实验室平台则提供参考区间研究报告作为审评材料。这种机制可以显著减少企业在参考区间研究方面的时间成本,同时解决研究样本代表性的问题。此外,医学实验室提供的样本,在进入医院时可无需再次验证,也节省了医学实验室进行重复参考区间验证的成本。
引用本文
胡琳琳*,杜昕昱,李蓓,白馥,李楚桐,刘玉.我国体外诊断试剂参考区间监管现状分析和思考[J].中国食品药品监管.2024.07(246):68-75.

来源:中国食品药品监管杂志


