您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-10-31 08:14
细胞系基因敲低常见的方法包括:shRNA、siRNA、CRISPR/Cas系统及sgRNA,我主要分享shRNA敲低细胞系表达的方法,其大致原理为将shRNA连接到PLKO的质粒中,将质粒转染进细胞,在细胞质中,质粒可以转录出一段与目的基因互补的单链RNA,这条互补RNA与目的基因的mRNA互补结合后,会特异性的将目的基因的mRNA降解,从而使目的基因翻译的模板减少,达到敲低目的基因的效果。
主要的方法步骤如下:
1.shRNA序列设计:
shRNA可在网页在线设计,设计完成后送至公司合成。
2.shRNA序列退火
1)将公司合成的shRNA序列常温4000rpm离心1min,按包装管上的指示加入相应微升的超纯水到相应的浓度,根据实验所需取部分稀释到10μmol。
2)水浴锅提前设置到95℃,退火体系50μL按下表依次加入相应试剂,95℃退火4min。
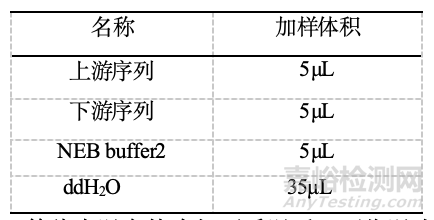
3)退火完成后,等待水温自然冷却至手温后,可将退火后的shRNA放入冰箱4℃暂存。
注意:shRNA合成后一般为粉末状,合成公司不同处理方式不同,根据说明书处理即可。
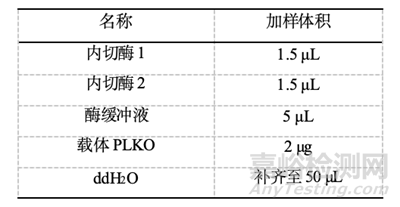
3.双酶切敲低载体PLKO
酶切位点的选择提前进行查询,常见酶切体系如下,37℃酶切1h。
4.琼脂糖凝胶鉴定酶切结果
根据载体大小配置琼脂糖凝胶并跑电泳,根据酶切片段计算片段出现的位置,以此判断载体酶切是否成功,可能出现的结果如图所示:

5.胶回收(根据回收试剂盒的操作步骤进行即可)
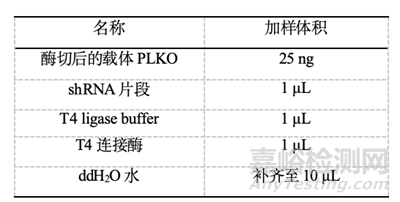
6.shRNA和酶切后的载体连接
连接体系10 μL,按下表依次加入相应试剂,振荡混匀并离心,16℃连接4 h或过夜。
连接结束后将样品放入冰箱4℃暂存。
7.连接产物转化、摇菌、测序
连接产物转化摇菌及提质粒均按常规步骤操作即可,质粒提取结束根据浓度取一定微升的原液送公司测序,查看载体构建是否成功。
8.慢病毒包装、筛选
1)提前一天在6 cm培养皿中铺HEK-293T细胞,保证第二天密度可达70%左右。
2)准备相应数量的高压后的Ep管,加入慢病毒包装质粒4 μg(PSA 3μg +PMD2G 1μg)、4 μg测序正确的质粒和200 mL Opti-MEM混匀(单个质粒),再加入24 μL PEI,轻轻混匀,室温静置10 min。
3)将提前一天铺好的293T细胞换液,换成10% FBS转染培养基1.5 mL,注意小心操作,尽量避免细胞悬浮。
4)静置10 mins后,每Ep管中加入1 mL 10%FBS转染培养基,轻轻混匀,将其全部轻轻加入培养皿中,4 h后换完全培养基 6mL。
5)转染40 h后小心收集病毒上清,使用0.22 μm的过滤网进行过滤,过滤完成后冰箱4℃可短暂保存。
6)待构细胞提前一天使用6孔板铺板,保证感染前细胞密度达60%以上,同时应选用状态最好的细胞。
7)小心吸掉待构细胞6孔板中的原培养基,加入4 mL含嘌呤霉素(由载体本身决定)的细胞的培养基(嘌呤霉素终浓度为1.5 μg/mL),加入PBS浓度梯度稀释好的病毒液,十字混匀后放入细胞培养箱。
8)6孔板每两天换一次含嘌呤霉素的培养基2 mL,大约筛选一周对照组细胞死亡,稳转细胞成型。

来源:实验老司机


