您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-11-14 16:48
连续制造技术是一种已被证明有极大优势的新兴技术。相比于传统的批量制造,连续制造拥有更集成、单元操作更少、设备占用空间小、工艺放大变异性小、过程质控更及时等特点,但在制药领域仍处于应用初期。化药口服固体制剂作为连续制造在制药领域的先行实验,仍面临一些挑战。因此,本研究通过综合文献研究和实验数据分析,提出了一些基于质量控制的连续制造策略,以确保化药口服固体制剂的质量稳定性。
2022 年 12 月 5 日,ICH 通过的 ICH Q13 指南描述了针对连续制造(continuous manufacturing,CM)过程实施的监管考虑和科学方法以及连续制造在制药行业中的运营和生命周期管理方面的建议。ICHQ13 的颁布意味着连续制造药品的方法已经被正式纳入国际药品监管的指南之中。这项法规为制药企业提供了一系列指导,以确保其在实施连续制造药品时遵守最高标准和规定,并能够有效地管理和控制生产过程中的各种风险。
在传统的批量生产模式下,制药企业通常面临制造过程中的批次变异性、产品质量波动性和生产效率低下等问题。而连续制造模式则可以通过实时监测和控制关键参数,实现制造过程的稳定性和一致性。这种模式不仅可以提高产品质量的可预测性和可控性,还能够减少生产周期、提高生产效率并降低生产成本。
然而,要实现化药口服固体制剂连续制造质量控制的目标,仍然面临着一些挑战。首先,制药企业需要严格控制物料属性、硬件设备,并对所得数据进行分析和处理。其次,需要建立合适的工艺检测和控制策略,以确保制造过程的稳定性和一致性。此外,制药企业还需要加强物料的可追溯性、分流以及工艺验证等技术的应用,以保证制造过程的完整度[1]。
为了解决上述问题并推动口服固体制剂连续制造质量控制的发展,本研究提出以下发展策略:控制物料属性稳定,保障药品质量安全;突破关键核心技术,改进连续制造设备;运用过程分析技术,实时控制产品质量;实现物料可追溯性,有效剔除不合格品。希望本研究的结果能为制药企业提供参考和指导。
1、连续制造监管政策概况
1.1 美国连续制造监管政策
连续制造作为先进技术,不仅受到美国 FDA 的政策加持,在美国联邦政府层面也多次被鼓励,已经纳入美国制药行业的“顶层设计”。连续制造也纳入美国 FDA 预防和缓解药品短缺的战略计划,因为支持制造业现代化也是通过解决潜在短缺的根本原因来缓解药物短缺的长期战略的重要部分[2]。美国 FDA 发布的相关指南见表 1。
表 1 美国 FDA 连续制造相关指南汇总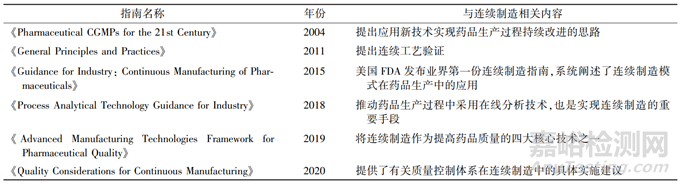
1.2 欧盟连续制造监管政策
2017 年,欧洲 EMA 在会议上提出目前监管框架足够支持连续制造的看法,表明了对药品创新制造技术支持的态度。尽管欧洲 EMA 还未提出具体的指南,但是 2 个连续制造应用已通过集中审批程序审评, 其中之一就是 EMA-FDA QbD 试点项目。为进一步推动药品创新技术的发展,欧洲 EMA 成立了 2 个小组,分别为药品过程分析技术(process analytic technology,PAT)小组和创新专责小组。PAT 小组的任务是研究和推广药品制造过程中的分析技术,以提高药品的质量和效果。
通过成立这 2 个小组,欧洲 EMA 旨在为制药行业提供支持和指导,以确保药品创新技术的安全性、有效性和合规性。这些专家将与制药公司和其他利益相关者合作,共同推动药品创新制造技术的发展,并为相关的政策制定和监管事务提供专业建议。其工作将有助于推动欧洲药品监管体系与时俱进,以适应不断变化的制药行业需求,并为患者提供更安全、有效的药物治疗选项[3]。欧洲 EMA 发布的相关指南见表 2。
表 2 欧洲 EMA 连续制造相关指南汇总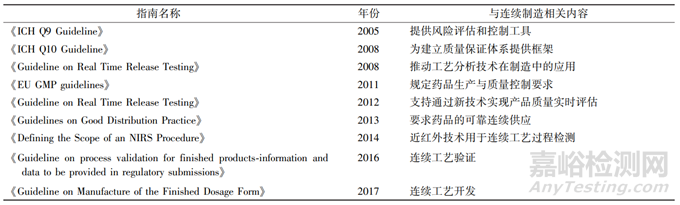
1.3 日本连续制造监管政策
同样,日本独立行政法人医药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA) 也一样高度重视连续制造。2018 年,日本 PMDA 批准了一项连续制造片剂产品上市的申请,标志着连续制造相关技术在日本医药行业的应用获得了显著性突破。通过与其他监管机构的合作和支持,PMDA 将继续推进创新制造技术的发展和应用[4]。其对于将连续制造技术应用于药品生产有多方面的考量,包括批次定义、验证和稳定性实验、控制策略等[5]。日本 PMDA 发布的相关指南见表 3。
表 3 日本 PMDA 连续制造相关指南汇总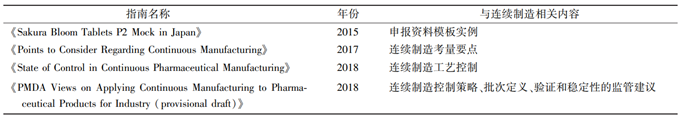
1.4 我国连续制造监管政策
相比美国、欧盟和日本,连续制造作为一种先进的药物生产工艺在我国的起步较晚。该工艺的运用对企业的人才储备、技术实力和管理水平提出了更高要求,需要企业从战略高度进行规划和部署,加大研发和人才投入。然而,目前我国的监管政策对连续制造还没有明确规定,一定程度上制约了企业采用这种新工艺的积极性[6]。不过,自 2018 年 ICH 成立 Q13 连续生产的质量议题以来,国家药品监督管理局(National Medical Products Administration,NMPA) ICH 办公室也相应成立了连续生产国内核心工作组,积极参与连续制造指南起草工作(见表 4)。
表 4 我国 NMPA 连续制造相关活动
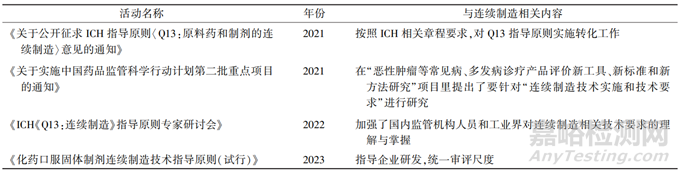
2、全球化药口服固体制剂连续制造技术应用现状
2.1 产品获批情况
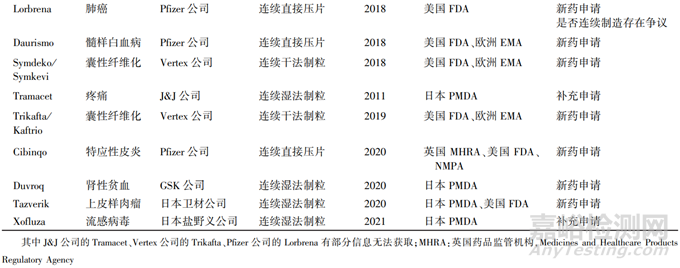
自美国 FDA 于 2015 年首次批准连续生产工艺申请以来,连续制造在整个行业的实施一直在稳步增长[7]。根据美国 FDA 药品审评中心 (Center for Drug Evaluation and Research,CDER) 药品质量办公室 (Office of Pharmaceutical Quality,OPQ) 的 2019 和 2020 年年度报告显示,多项使用连续生产工艺的品种申请已批准[8]。具体信息如表 5 所示:共有 12 种药品,涉及 7 家企业,3 种生产工艺(连续湿法制粒、连续直接压片、连续干法制粒),来自美国 FDA、欧洲 EMA、日本 PMDA 以及 NMPA 共 23 个批件,其中有 3 种药品作为补充申请进行申报,其余则是作为新药申请进行申报。
表 5 已获批上市的连续制造技术产品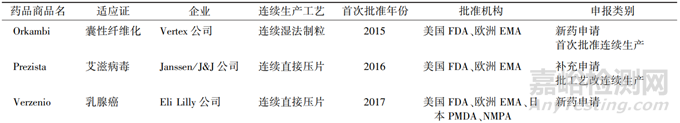
2.2 产品的研发过程关注点
通过近些年国外(欧洲、美国、日本)注册或获批的采用连续制造工艺的产品的批准情况来看,在产品的研发过程中有以下关注点:① 连续生产技术的开发要求相关的工艺、工程和设备达到相应水平,相辅相成。② 处于早期开发阶段的连续生产技术,需通过频繁沟通、实地考察和多方努力。③ 工艺由传统工艺变为连续生产工艺,需与监管机构进行密切沟通和讨论如何进行桥接。④ 连续生产技术中使用的模型会根据数据进行更新,此类更新是否需要申报及申报类别[9]。如果模型用于和产品质量相关的决定则需要申报,但针对工艺开发使用的模型无需申报。
2.3 产品注册申报关注点
通过对已上市产品获批情况的初步分析发现,在产品注册申报中,监管部门通常会关注以下问题:① 批量的定义。可由生产时间或重量进行定义。利用延长生产时间来增加批量,若其他参数不变,则由公司内部质量体系进行管理。② 工艺验证。采用了连续工艺验证的理念。基于美国 FDA《工艺验证:一般原则和实践》指导原则中提及的三阶段验证法,包括工艺设计、工艺确证、持续工艺确认。③ 技术转移。对于技术转移所需的研究和数据可以大大少于传统工艺技术转移所需数据,仅要求对比不同生产厂连续生产的设备。④ 清洁验证。使用与传统生产工艺同类的清洁剂,学习相关清洁步骤和其分析方法以及最后的验证方案等。⑤ 控制策略。使用多个控制要素并制定应急计划。当近红外光谱法(near⁃infrared,NIR)不可用时,使用分时取样和离线检测。开发期间以及工艺验证阶段,考虑采取分时取样离线分析和在线NIR 实时分析 2 种模式进行检测;对于商业化生产,当在线 NIR 不可用时,考虑根据定义的取样间隔取样[10]。⑥ NIR 技术的稳健性。基于大量的研究数据和稳健性的验证。⑦ 物料追溯性。需要考虑如果生产后发现物料不符合质量标准,如何追溯到成品;如果成品不符合质量标准,如何溯源到物料。
在批生产记录中记录所使用的各物料批号,以保证可追溯性;使用时间标记,直接关联物料和成品;如果物料不符合质量标准,对使用到该物料的全部成品进行调查[11]。
美国和欧洲等国家或地区连续制造技术在药物制造领域得到广泛应用,连续制造技术能够实现高效、快速、精确地制造,提高生产效率和产品质量,降低生产成本[12]。国内在连续制造技术的应用上相对较落后,虽然一些大型制药企业开始尝试连续制造技术,但整体应用还较为有限。目前,国内主要使用的还是传统的间歇式制造工艺。
综上,国内在化药口服固体制剂连续制造技术应用方面与国外存在较大差距。要缩小这一差距,需要加强技术研发、加强人才培养、改善制度环境等方面的努力。
3、化药口服固体制剂连续制造质量控制策略分析
连续制造过程的质量控制是保证连续制造药品质量的前提。化药口服固体制剂连续制造过程必须有严格准确的控制策略,目的是实时监控物料、中间体和成品参数的信息,与此同时在物料输送过程中,对实时干扰和工艺偏差进行检测,从而实现更精确的工艺控制,降低对产品质量可能产生的风险[13]。制定化药口服固体制剂连续制造质量控制策略可以从以下几方面进行考虑。
3.1 物料属性
物料属性会影响连续制造运行的诸多方面,了解制备化药口服制剂所用到的物料属性及其变化对工艺过程以及产品质量的影响,对于化药口服固体制剂连续制造设备的设计、连续工艺研发和工艺控制策略的制定具有非常重要的影响[14]。通过基于风险的方法找到可能影响关键质量属性的关键物料属性和关键工艺参数。输入物料属性的变化会影响进料工艺、实时动态码相位差分 (real time differential,RTD) 模式,并可能进一步影响化药口服固体制剂成品质量。
3.2 硬件设备
对硬件设备来说,要重点考虑制备化药口服固体制剂所选择的具体工艺,每种工艺的制造设备及制造流程都有不同。以化药口服固体制剂进料设备为例,进料作为连续制造工艺第一个单元操作,也是最有可能引入杂质或扰动的单元操作。目前多种连续制造工艺所运用的进料机均为失重式进料机 ( loss in weight feeder,LIWF) 。 但失重式进料机在实际生产过程中存在以非常低的流速进料和流动性差粉末(具有显著的静电黏附力)的进料过程,在这种情况下产品质量可能受到影响。 如果在失重式进料机没有任何创新性改进的情况下,化药口服固体制剂的质量将受到失重式进料机的限制。
3.3 工艺的检测和控制
目前,采用连续生产的制药公司有 3 种工艺流程选择,分别是连续直接压片、连续湿法制粒和连续干法制粒。工艺检测与控制有助于维持化药口服固体制剂生产过程中的受控状态,并允许实时评估系统性能。连续制造工艺在启动后一直是动态的,在操作过程中,各单元操作的工艺参数也是持续保持接近目标值,而不是处于稳态状态。工艺参数对工艺质量有着重大的影响,如连续湿法制粒中某些黏合剂的温度会对工艺质量有一定的影响,在实际生产中发现:淀粉浆温度对某些特殊品种有较大影响,对这些品种而言,应对黏合剂的温度有一定的控制;再如连续干法制粒中,压辊压力是关键的工艺参数,压辊压力过小,压出的料片易碎,容易造成细粉量多;虽然连续直接压片工艺简单、生产效率高,但在实际的生产中,粉末直接压片对辅料、压片机及其装置的要求非常高,对关键物料属性和工艺参数的考量要求做到严密且精准。因此,化药口服固体制剂连续制造需要维持工艺处于受控状态,发现瞬时工艺扰动,将可能产生的不合格物料及时从系统中分流,降低潜在扰动对产品质量的影响。有效的化药口服固体制剂连续制造工艺控制应该了解不同单元操作之间的先后作用,保证药品最终质量[3]。
3.4 物料的可追溯性和分流
因为化药口服固体制剂连续制造工艺包括生产不合格物料期间。所以从产品流中分流出不合格物料的能力是连续制造的一个重要特征[15]。了解化药口服固体制剂连续制造过程中单个单元操作与整合系统的工艺动态可以跟踪物料随时间的分配。这能够在整个生产工艺中跟踪输入物料、确保物料可追溯、了解上游扰动如何影响下游物料质量以及使用恰当的测量。目前缺乏合适的化药口服固体制剂连续制造实验和中试设备,干燥固体和固体流体的处理较为困难。
4、化药口服固体制剂连续制造发展策略
连续制造与传统“批”生产不同,物料在单元操作之间持续流动,持续产出产品[16]。所以对于连续制造面临的一系列问题,必须突破传统质量管理模式,建立新的质量控制策略。为推动化药口服固体制剂连续制造质量控制的发展,本研究提出以下发展策略。
4.1 控制物料属性稳定,保障药品质量安全
在化药口服固体制剂连续制造生产运行期间,可通过进料系统连续输入物料。物料的属性可能影响进料、影响 RTD 模型以及成品质量。因此,化药口服固体制剂连续制造应保证输入物料的属性稳定并且优于药典标准。通过风险分析、实验研究、建模和模拟,以评估在预期生产运行期间的物料属性和赋形剂的粒径分布和密度的潜在影响[17]。
4.2 突破关键核心技术,改进连续制造设备
制药企业想要发展化药口服固体制剂连续制造,首先必须解决连续制造设备问题。以化药口服固体制剂的连续制造技术为例,主要涉及设备包括进料机、共研磨机、辊压机等,同时还需运用 PAT 对中间体和终产物进行实时监测,对生产过程进行实时控制,进而保证化药口服固体制剂的产品质量[18]。目前,本土制药企业需按照流程完成进口采购设备,才能拥有一条完整的化药口服固体制剂连续制造生产线。因此,建设国产化的以药品生产工艺和连续制造设备为核心,以数据为基础,建立虚实结合、知识主导、安全有效、低碳环保的化药口服固体制剂连续制造生产线非常重要。
4.3 运用过程分析技术,实时控制产品质量
化药口服固体制剂连续制造过程中的控制策略,主要是对所使用原辅料的属性进行识别、对单元操作以及过程分析技术进行控制。这些控制策略涉及不同物料、工艺过程和设备,并能够对出现的问题进行实时处理或发出警报。其中过程分析技术对关键质量属性或影响关键质量属性的物料参数进行检测,该技术不仅可以保证工艺性能和化药口服固体制剂的质量,还能够为检测抽样计划和频率提供依据[19]。
4.4 通过物料可追溯性,实现不合格品的剔除
在批生产过程中,通过记录物料批号可以对物料进行追溯。然而,对于化药口服固体制剂连续制造工艺的审评来说,需要关注不合格物料产生的时间段。如果能够掌握物料可追溯性、工艺监控和物料移除的方法,则可在不影响批次中合格产品的情况下去除不合格物料。因此,化药口服固体制剂连续制造系统的设计应该在关键生产阶段的开始或结束时考虑设立分流点。这些分流点可以有效地将不合格物料从生产流程中移除,从而确保最终产品的质量。制药企业可以采用有效的物料记录手段对物料实现追溯,有效排除不合格品[20]。
5、结语
口服固体制剂的连续制造工艺主要适用于开发高需求、低价格或低需求、高价格的药品。我国一直在积极引进药品连续制造技术,并探索将其应用到化药口服固体制剂的生产中。但我国在有关药品实际生产与监管方面均缺乏实战经验,使得连续制造技术在我国落地转化面临诸多挑战。因此,我们亟须重视有关连续制造质量控制,为推动化药口服固体制剂连续制造质量控制的发展,发展策略的制定可以从物料属性及硬件设备、工艺的检测和控制、物料的可追溯性和分流以及工艺验证等方面进行考虑。针对以上问题本研究提出以下几点建议:控制物料属性稳定,保障药品质量安全;突破关键核心技术,改进连续制造设备;运用过程分析技术,实时控制产品质量;实现物料可追溯性,有效剔除不合格品。目前连续制造在国内尚处于起步阶段,制药领域在连续制造的可借鉴经验较少,政府监管机构可与制药企业合作,选择 1~2 个工艺简单稳定的口服固体制剂进行试点研究,并给予适当的政策倾斜,例如强化对共性关键领域的研发和资助,鼓励新技术的开发、应用,通过试点运行总结连续制造相关经验,稳步推进连续制造在我国的实施应用。相信通过政府、企业以及科研院所的共同努力,一定能推动我国制药行业连续制造技术的进步,推进我国迈向“制药强国”的战略目标。
参考文献
[1] 曹辉, 葛渊源, 陈刚, 等. 基于 ICH Q13 的碳酸钙原料药连续制造监管探析[J]. 中国药事, 2022, 36(4): 384 - 390.
[2] FDA. Guidance for Industry: PAT-A Framework for InnovativePharmaceutical Development, Manufacturing, and Quality Assurance[EB/ OL]. (2004 - 10 - 01 ) [2021 - 10 - 08 ]. https: / /www. fda. gov / media / 71012 / download.
[3] 上海医药行业协会. 上海医药行业协会举办“应用连续制造技术促进医药制造业转型发展研究”开题会[ J]. 上海医药,2021, 42(7): 34.
[4] 曹萌, 丁力承, 胡延臣, 等. 药品连续制造全球监管发展现状与思考[J]. 中国药事, 2022, 36(4): 364 - 376.
[5] 胡延臣. 药品连续生产及全球监管趋势[J]. 中国新药杂志,2020, 29(13): 1464 - 1468.
[6] FDA. REPORT ON THE STATE OF PHARMACEUTICAL QUALITY: FISCAL YEAR 2019[EB/ OL]. (2020 - 01 - 01) [2021 -12 - 10]. https: / / www. fda. gov / media / 135046 / download.
[7] FDA. CENTER FOR DRUG EVALUATION AND RESEARCHOFFICE OF PHARMACEUTICAL QUALITY 2020 ANNUALREPORT[EB/ OL]. ( 2021 - 01 - 01 ) [2021 - 12 - 10 ]. https: / / www. fda. gov / media / 145830 / download.
[8] NI HF, HE YQ, SHEN HC, et al. Research progress of continuous manufacturing and process knowledge system of traditionalChinese medicine[J]. China J Chin Mater Med, 2021, 46(8):2045 - 2050.
[9] 王子千, 王学成, 钟志坚, 等. 中药口服固体制剂连续制造技术应用现状、趋势与挑战[ J]. 中国中药杂志, 2023, 48(16): 4536 - 4544.
[10] 孙钟毓, 林泊然, 李爽爽, 等. 国内外已上市连续制造口服固体制剂药学审评内容的研究与启示[ J]. 中国食品药品监管, 2022(9): 54 - 77.
[11] 曹萌, 葛渊源, 胡延臣, 等. 口服固体制剂连续制造物料处理考虑及监管检查要点探讨[J]. 中国医药工业杂志, 2022,53(10): 1394 - 1401.
[12] 葛渊源, 曹辉, 胡延臣, 等. 连续制造技术的监管策略及挑战[J]. 中国医药工业杂志, 2022, 53(6): 904 - 911.
[13] 唐艺菲, 吴闻哲, 王健. 连续制造在口服固体制剂中的研究与应用[J]. 中国医药工业杂志, 2022, 53(9): 1227 - 1239.
[14] 仝永涛, 高春红, 高春生. 口服固体制剂连续生产与过程控制技术研究进展[J]. 中国新药杂志, 2017, 26(23): 2780 -2787.
[15] 邹文博, 周桂勤, 罗苏秦, 等. 过程分析技术在制药连续制造的质量控制策略[J]. 中国新药杂志, 2021, 30(10): 937 -946.
[16] 梁钧杰, 张尧, 潘浩敏, 等. 片剂连续制造中在线检测技术应用进展[J]. 中国新药杂志, 2024, 33(8): 774 - 784.
[17] 梁子辰, 唐雪芳, 杨平, 等. 中药连续制造研究进展和成熟度评估[J]. 中国中药杂志, 2023, 48(12): 3162 - 3168.
[18] 王芬, 徐冰, 刘雨, 等. 中药质量源于设计方法和应用:连续制造[J]. 世界中医药, 2018, 13(3): 566 - 573.
[19] YU H, ZHANG YF, MA YH, et al. Hot melt extrusiontriggeredamorphization as a continuous process for inducing extended supersaturable drug immediaterelease from saSMSDs systems[ J].Pharmaceutics, 2022, 14(4): 765.
[20] MADARÁSZ L, KÖTE Á, HAMBALKÓ B, et al. Inline particle size measurement based on image analysis in a fully continuous granule manufacturing line for rapid process understandingand development[J]. Int J Pharm, 2022, 612: 121280.
本文作者李香玉1,2,林晓凤1,兰毅鹏1,黄哲1,1 沈阳药科大学工商管理学院,2 上海药品审评核查中心,来源于中国新药杂志,仅供交流学习。

来源:Internet


