您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-02 12:32
近日,蓝帆医疗心脑血管事业部子公司——山东吉威医疗制品有限公司研发和生产的新一代雷帕霉素类药物涂层球囊(优美莫司涂层冠状动脉球囊扩张导管)获得国家药品监督管理局批准注册(国械注准20243032218)。该产品使用公司独家专利技术的高亲脂性药物Biolimus A9TM(BA9),适用于血管直径 2.0mm-2.75mm 的原发冠状动脉血管病变治疗。
此次新一代雷帕霉素类药物涂层球囊产品的研发成功及获批上市,有利于蓝帆医疗进一步完善冠脉植介入领域的高值医疗耗材产品组合,增强其在该领域的核心竞争力。
公司上一代“优美莫司涂层冠状动脉球囊扩张导管”是国内首款雷帕霉素类冠脉药物涂层球囊,2022年9月获批原发小血管适应症,2024年10月又获批支架内再狭窄(ISR)适应症。
据官方介绍,截至2024年11月26日,国内其他厂商已上市的药物涂层球囊(DCB)/药物洗脱球囊(DEB)产品均采用了具有脂溶性特征、但生物毒性较强(安全剂量范围窄)的紫杉醇作为抗增殖的药物选择,而蓝帆医疗产品攻克了雷帕霉素类药物难以应用于药物球囊的壁垒,为药物球囊提供了安全剂量范围更大、安全性更高的药物选择。
研发背景
从现阶段情况来看,以其所应用的药物不同性质作为分类标准,可将现有的DCB产品大致划分为紫杉醇DCB、西罗莫司DCB和佐他莫司DCB。虽然国外的DCB产品种类繁多,但之前国内对DCB的使用仅限于紫杉醇DCB一种。
根据Katsanos等的Meta分析显示,紫杉醇组2年内全因死亡率显著高于对照组(死亡风险为7.2%vs.3.8%),5年内的全因死亡率则进一步增加,因此关于紫杉醇长期安全性的争议已经引起了专家们对其安全性的广泛讨论。
研究发现,以雷帕霉素类(如佐他莫司和西罗莫司)为药物涂层的DCB结合纳米技术可延长DCB的疗效维持时间,而研发耐久性更佳的药物涂层技术也是未来DCB发展的重点。
《药物涂层球囊临床应用中国专家共识(第二版)2024》中指出:紫杉醇具有亲脂性强的特点,能快速被血管壁均匀摄取,且其抗增殖作用稳定,能够持久抑制平滑肌细胞的增殖。因此,早期DCB均选择紫杉醇作为药物涂层,随着近年来科技的发展,采用新的药物输送技术,如纳米技术、生物可降解多聚微球、球囊微孔等,已经可以实现可控释放雷帕霉素,并由此研发了新一代雷帕霉素DCB, 成为临床DCB治疗的新选择, 其有效性和安全性得到多项临床研究证实。
雷帕霉素是一种强效的抗细胞增殖药物,它能够有效抑制细胞的过度生长和分裂,从而防止血管狭窄和堵塞。由于具有较强的抑制细胞增殖的能力,在临床上被广泛用于抑制器官移植术后的免疫排斥反应。大量动物和细胞实验证明,雷帕霉素通过作用于哺乳动物雷帕霉素靶蛋白,降低mTOR磷酸化水平,从而抑制mTOR信号通路在胞内的传递,发挥抑制细胞生长和迁移,促进自噬等作用。
然而,相对于紫杉醇,DCB在载药技术方面难以攻克雷帕霉素类药物亲脂性差的特点,致使其药物利用率低,无法获得与紫杉醇类药物相同的有效性临床终点,因此迟迟未能应用于药物涂层球囊上,急需新的药物传递方式改善雷帕霉素的生物利用率。
产品介绍
新一代优美莫司涂层冠状动脉球囊扩张导管
注册证编号:国械注准20243032218
注册人名称:山东吉威医疗制品有限公司
管理类别:第三类
型号规格:BA9BP-2010、BA9BP-2015、BA9BP-2020、BA9BP-2025、BA9BP-2030、BA9BP-2210、BA9BP-2215、BA9BP-2220、BA9BP-2225、BA9BP-2230、BA9BP-2510、BA9BP-2515、BA9BP-2520、BA9BP-2525、BA9BP-2530、BA9BP-2710、BA9BP-2715、BA9BP-2720、BA9BP-2725、BA9BP-2730
结构及组成/主要组成成分:
该产品由球囊扩张导管及球囊上的药物涂层组成,球囊导管由球囊、远端管、过渡管和近端管等组成。药物涂层含有优美莫司和聚环氧乙烷载体,药物剂量为3μg/mm2。
适用范围/预期用途:
用于血管直径 2.0mm-2.75mm 原发冠状动脉血管病变的治疗。
上一代“优美莫司涂层冠状动脉球囊扩张导管”

柏腾™优美莫司涂层冠状动脉球囊扩张导管(BA9DCB)是公司下属子公司吉威医疗自主研发的国内首款获批的莫司类药物涂层球囊,该产品使用公司拥有独家专利技术的高亲脂性药物 BiolimusA9TM(BA9),此前已于2021年8月进入国家药监局创新医疗器械特别审查程序。
柏腾™BA9DCB由球囊扩张导管及球囊上的药物涂层组成,球囊导管由球囊、远端管、过渡管和近端管等部件组成。药物涂层含有优美莫司和聚环氧乙烷载体,药物剂量为3μg/mm2,可用于冠状动脉支架内再狭窄和血管直径 2.0mm-2.75mm 原发冠状动脉血管病变的治疗。
该产品通过聚环氧乙烷载体将优美莫司药物粘附在球囊表面,聚环氧乙烷的亲水特性和优美莫司的亲脂特性使药物可以从球囊表面释放并快速进入血管壁。药物球囊作为一种血管内药物释放技术,能在病变部位释放有效治疗浓度的药物,解决并治疗冠心病介入及支架内再狭窄病变。
2021年11月,柏腾™BA9DCB相关临床研究结果BIO-RISECHINA在美国佛罗里达州奥兰多举办的2021年经导管心血管治疗学术会议最新临床试验结果环节(TCT2021LateBreakingClinicalScience)中公布,成为首个临床研究在TCT会议平台重磅环节专场公布的国产药物涂层球囊。
柏腾™凭借公司独家专利的BA9药物、结合独特的晶体化工艺、配合PEO亲水涂层,攻克了雷帕霉素类药物难以应用于药物球囊的壁垒,有力填补了雷帕霉素及其衍生物在DCB领域中应用的空白。
另一方面,柏腾™目前已扩充至50种规格型号,最大长度为45mm,充分满足不同血管解剖结构的临床应用需求,为PCI精准治疗提供更加全面的选择。
药物涂层球囊市场概况
裸金属支架(BMS)的出现在一定程度上解决了球囊扩张后可能会面临的血管壁夹层、血管急性闭塞和血管弹性回缩等问题,但却带来了另一个严峻的挑战,即支架内再狭窄。金属支架对血管内膜的持续性刺激,可导致血管内膜增生过度,引起支架内再狭窄(ISR),发生率可达30%。
药物涂层球囊扩张术使药物作用于血管内壁,维持血管通畅效果更佳且不留异物在血管内,在血管内再狭窄ISR、小血管、分叉病变有明显优势,原发病变的扩展也不断探索验证。
随着近年来“介入无植入”理念的推广,药物涂层球囊使用量快速增长。根据弗若斯特沙利文预测数据,药物涂层球囊首次在中国获批用于冠状动脉疾病的治疗后,使用量从 2016 年的 7500 个大幅增长至 2021 年的 29.0 万个。预计 2025 年市场规模将进一步攀升至 100.0 万个,2030 年预计将达到 204.2 万个。
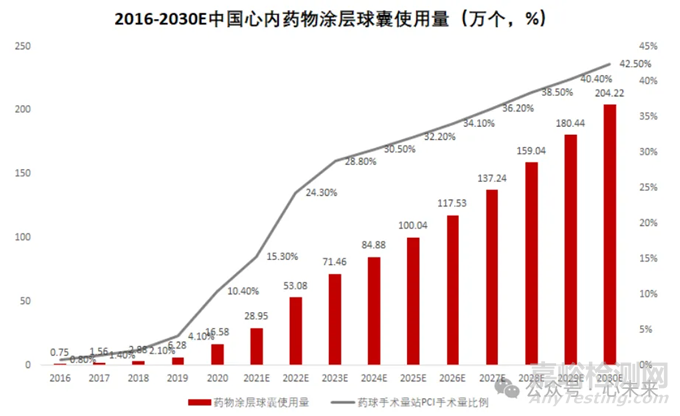
▲源于弗若斯特沙利文
根据弗若斯特沙利文预测数据,国内冠脉药物涂层球囊的市场规模从 2016 年的 1.35 亿元大幅增长至 2021 年的 20.09 亿元,预计 2025 年市场规模将进一步攀升至 43.86 亿元,2030 年预计将达到 59.33 亿元。
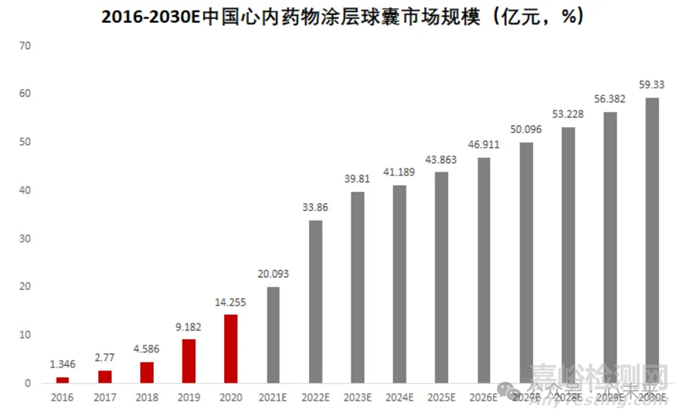
▲源于弗若斯特沙利文
冠脉药物涂层球囊是高端第三类医疗器械,产品具有高精密技术,进入壁垒较高的特点。我国药物球囊行业发展起步较晚,发展时间较短,国内市场由数家公司主导,仍有较大的进步空间。
德国贝朗的 SeQuent Please 是我国最早上市的药物涂层球囊,其适应症为冠状动脉支架内再狭窄治疗。垠艺生物的轻舟®药物洗脱球囊于 2017 年获原国家食品药品监督管理总局(CFDA)优先审批上市,是国际首个适用于原发冠脉分叉病变的产品,也是国内首个取得注册证的产品。
随着临床应用研究逐步开展,参与者陆续取得冠脉药物球囊产品注册证,如上海申淇、乐普医疗、凯德诺(远大医药)、赢生医疗、巴泰医疗、鼎科医疗。未来随着更多竞争对手和竞品进入市场,市场竞争将加剧,但竞品的进入也将进一步加强行业的国内市场教育,促进产品市场渗透率提高。
其中,垠艺生物的轻舟®药物洗脱球囊具有出色的通过性及输送性、优异的药物涂层品质,已在多家知名心血管医院及国内逾千家医院进行临床应用,上市后销量增长较快,打破了德国贝朗的市场垄断。

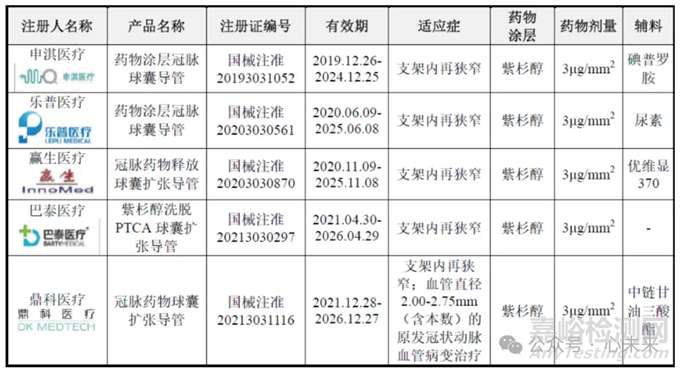
▲冠脉药物球囊竞品信息对比(源于垠艺生物招股说明书)
申淇医疗是国内第二家获证的DCB企业,其研发的淇济®swide®药物涂层冠脉球囊导管使用紫杉醇+碘普罗胺的药物组合,拥有创新超声喷涂技术,致密性更好,而且可在病变处停留长达28天。该产品于2019年在我国获批上市,适用于冠状动脉ISR的治疗。
鼎科医疗与美敦力合作研发的Dissolve™冠脉药物球囊于2021年12月在我国获批上市,球囊表面涂有紫杉醇,载体为中链甘油三酸脂,用于冠状动脉ISR和原发小血管病变的治疗。该球囊的三段式输送可以更好的保障药物充分转移且延缓稀释,优化的输送杆可保证力的传导、平滑过渡的导丝导入口可提高跟踪性。
除了上述企业外,还有浙江乾合畅脉医疗科技有限公司的紫杉醇药物涂层冠状动脉球囊扩张导管(2023年获批,用于分叉病变)、瑞维特医疗研发的药物涂层PTCA球囊扩张导管(2023年获批,用于小血管病变)、恒壹医疗冠脉药物涂层球囊扩张导管(2023年获批,用于ISR、分叉病变)等均已获批上市。
DCB技术作为行业新星,在多项临床数据结果上的表现与老牌选手药物洗脱支架无明显差异,而且再狭窄率,药物洗脱效率,药物传输效率,聚合物残留,无植入支架,晚期血栓风险方面表现优异。该赛道本土企业的加入也极大地改变了市场格局,如申淇医疗、乐普医疗和垠艺生物等在市场中的占比已经反超进口产品。在价格和政策环境的支持下,本土企业有望在未来的竞争中占据更大的市场份额。
关于蓝帆医疗
蓝帆医疗成立于2002年,作为一家始终坚持自主创新的企业,围绕2013年确立的“高值耗材+中低值耗材”(“A+X”)发展战略,拥有心脑血管事业部、防护事业部、护理事业部以及外科事业部四大板块。
在心脑血管领域,蓝帆医疗主要从事冠脉植介入、结构性心脏病以及和心脏介入手术相关的医疗器械产品的研发、生产和销售业务,设备产能超过187万条/年,经营主体之一的柏盛国际研发出全球第一款无聚合物药物涂层冠脉支架BioFreedom®,是目前全球首款同时获得中国、美国、欧洲、日本四大主要市场批准上市的专门应用于高出血风险患者的药物支架。
▲BioFreedom®药物涂层冠状动脉支架系统(源于官网)
在结构性心脏病介入领域,心脑血管事业部子公司上海蓝帆博元医疗科技有限公司自主研发的一次性使用冠脉血管内冲击波导管——Soni Cracker™-CL(国械注准20243030988)经过中国国家药品监督管理局(NMPA)的审查批准,正式获得NMPA医疗器械注册证,也是国产冠脉IVL第五证。
据2024年三季度报告,公司2024年前三季度营业收入为 46.5 亿元,比上年同期增长 29.85%;归属于上市公司股东的净利润为 -2.2 亿元,较上年同期亏损减少。报告期内经营活动产生的现金流量净额为 -6913 万元,总资产 169.81 亿元。
截至2024年7月,蓝帆医疗在 20 多个国家和地区拥有 70 家分子公司,在全球设立九大生产基地,分布在中国、新加坡、德国和越南等地,产品覆盖全球 130 多个国家和地区,已在中国上海、德国、瑞士、新加坡等地区设立了研发平台,构建了全球 24 小时研发体系,拥有近千名研发技术人员,全球专利 600 余项。

来源:心未来


