您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-10 08:40
细菌回复突变试验,是由Ames及其同事最早报道的,故又称Ames试验,用于评估潜在致突变或可能的致癌性。Ames试验结果阳性,通常会假定待测物具有致癌作用,并可能导致候选药物开发的终止。因此,致突变阳性、阴性的判定对于受试物的开发、监管机构评审、药物上市等均会产生影响。有多种途径可用于Ames数据评估,用的比较多的是倍数原则,比如≥平行设置的未经受试物处理组的2倍。另外,虽然没有普遍认可的统一的统计方法,但统计学方法也是其中一条路径,通常以p≤0.05计。即≥2倍或p≤0.05认为受试物具有致突变性或潜在致癌性。那么,这种思路究竟有没有问题呢?
先看下Ames试验的背景。该试验是由Ames等人在1973年开发的,后续又有其它团队做过优化。简言之,Ames试验采用基因工程改造的含DNA突变的鼠伤寒沙门氏菌和大肠杆菌进行研究,并分为添加或不添加S9的两种体系。S9是啮齿类动物肝脏代谢系统,常用的是大鼠肝脏匀浆物。加S9的原因是很多化合物经肝脏代谢后的代谢产物依然有生物活性,而细菌不具备代谢能力。Ames的基本原理是基因突变的沙门氏菌和大肠杆菌分别缺少组氨酸、色氨酸合成能力,在缺少这类氨基酸的培养基中无法存活,如果受试物引起基因突变,使以上菌株恢复组氨酸或色氨酸合成能力,则细菌正常生长,以此判断受试物的致突变风险。常用的菌株有5种,沙门氏菌TA98、TA100、TA1535、TA97/TA1537二选一、TA102或一株大肠杆菌菌株WP2uvrA/WP2uvrA pKM101。选择这些菌株的原因是它们具有不同的突变类型、可以检测不同DNA区域的敏感性、模拟不同DNA修复能力等,尽量增加检测的广度和深度,提高试验的覆盖面。
试验通常将1*108细菌暴露在受试物下,设置加或不加S9两种条件。按照OECD要求,除溶剂和阳性对照外,受试物至少需要设置5个剂量,剂量范围跨越3个数量级。每个剂量设置三复孔,突变菌落数量取均值。溶剂对照作为突变的背景值,该数值视不同菌株、加/不加S9、不同浓度或不同实验室操作,可能会有所差异。试验结果方面,5个菌株中,任意菌株阳性,均认为受试物具有致突变风险。反之,如果受试物被视为无致突变风险,则需要在OECD指定的5种菌株中均进行过测试,且结果都是阴性。
阳性结果的定义
阳性的界定是Ames试验的关键。在任何具备分裂能力的细胞和生物体中,都会存在天然突变。所以,Ames试验中设置的溶媒对照(受试物剂量为零),背景突变也不是零,这一数值因菌株或其他因素所致也会有差异。问题的关键是超过平行设置的溶媒对照多少才视为阳性。
1979年,美国国家毒理学计划遗传毒性测试项目指出无论受试物组菌落数较对照组增加几倍,必须要有可重现的,剂量相关性增加。
OECD 471(1983a)对结果的评价和解释部分指出有几个标准可用于阳性结果判定,比如受试物菌落数出现浓度相关增加和/或在至少1个菌株(加或不加代谢活化系统)的1个或多个浓度的每皿菌落数的增加可重现。应首先考虑结果的生物学相关性(biological relevance)。统计学方法可以作为辅助手段,但不能作为判定阳性的唯一手段。OECD 472(1983b)中有过一致描述。
OECD 针对该指南的1997和2020版本指出“there is no requirement for verification of a clear positive response”,对生物学和统计学的描述与之前一致。但是,指南中并未给出clear positive或biological relevance的定义,也没有提供判断反应是阳性、阴性还是不确定结果的具体指导或建议。
NMPA 2018年《药物遗传毒性研究技术指导原则》指出,至少在一个菌株上,在有或无代谢活化条件下,受试物所诱发的回复突变菌落数出现浓度依赖性的增加和/或在一个或多个浓度上出现可重复性的增加,可判定为阳性结果。结果判定时应首先考虑试验结果的生物学意义,统计学分析有助于结果的评价。
如果判定生物学反应是供试品相关的,即阳性,该反应应该是与受试物浓度和/或暴露持续时间相关,并具备可重现性。某些情况下,还需要结合专家判断、受试系统的生物学特点等综合判定。
大部分Ames试验在区分致突变和非致突变方面是没有问题的,即明确阳性(clearly positive)、明确阴性(clearly negative)。前者可以明确看到浓度依赖性的突变增加,并超过平行设置的溶媒对照,且不需要统计学或进一步计算;后者突变数量与溶媒对照一样,且没有浓度依赖性的增加。如下图化合物A(阳性)和B(阴性)所示。这种类型的阳性和阴性判断称之为“inter-ocular rule”,即肉眼可见的判断,不需要统计也不需要其它形式的分析。
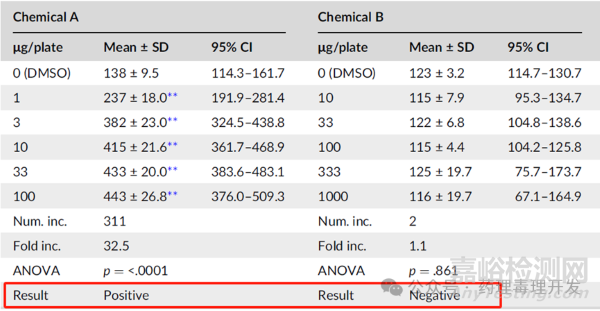
然而,总有些化合物Ames结果的阴性和阳性不是那么明显。突变增加的不多,且增加的趋势也不是那么单一,如果下图化合物C,低浓度不怎么增加,高浓度略有增加。按照2倍规则、3倍规则或者不同统计学处理,会得出不同的结论,可能最终结果就是“不确定”。
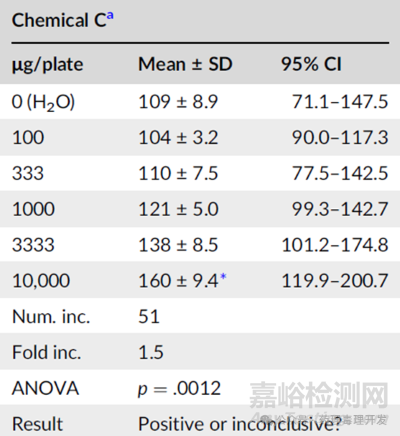
传统常见的阳性判断方法包括倍数法、ANOVA、95%置信区间、Bernstein模型。前文中的化合物A,无论采用哪种方法,都能得出阳性结论。化合物B则相反,无论哪种方法都是阴性。化合物C采用ANOVA或其他统计方法,阳性。采用2倍的倍数规则,则是阴性。95%置信区间法,高剂量落在了平行设置的溶媒对照之外,但可能落在了实验室历史溶媒对照的背景数据以内。化合物C面临的命运是,如果按照ANOVA或者Berstein模型,则该化合物具有致突变风险,可能会停止开发。如果按照2倍规则,则致突变阴性,有可能继续推进至临床阶段。
当下使用的判断标准和路径
大致分为5种情况:2倍或优化的2倍规则;统计学方法;超过历史对照范围;专家判断;以上多种方法联合使用。
倍数法
2倍或优化的2倍规则是目前使用最广泛,也是非常简便、容易操作的方法。最早源于1975年细菌回复突变发明人Ames团队,认为小于2倍的增加视为阴性。阳性结果或不确定结果需要进行确认,并有剂量-反应关系。但该实验室并未给出阳性反应的cut off值。
后续逐渐发现,对于某些菌株如TA1535、TA1537等的背景突变数量只有20或不到,2倍的背景计数视为阳性,不够保守。Dunkel等人1984年对这一规则进行了修订,认为对于低背景突变的菌株,超过2.5或3倍背景值方认为是阳性,并被广泛接受和使用。
不过,倍数法具体怎么操作未形成统一标准。是1个浓度超过2倍或3倍即视为阳性还是至少需要2个浓度达到这一标准?突变数量的增加需要有剂量相关性吗?三复孔之间的变异度(SD或SEM)需要考虑吗?没有达到2倍或3倍,但有明显的剂量相关增加趋势是视为阴性还是不确定?
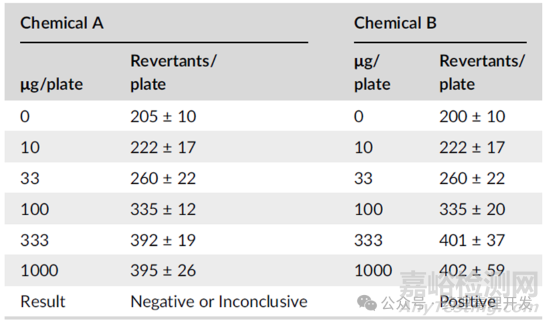
另外,这种严格的倍数规则,属于划一条线,过线即阳性,忽视了皿与皿之间的差异。可能会出现下表之中的情况,不同皿之间的溶媒对照计数略有差异,按照严格2倍规则计算,就会对结论造成影响。化合物B如果溶媒对照与化合物A一致,则致突变结果可能就是阴性或不确定。
统计学
统计学方法有一点与倍数规则法类似,都是通过划一条线,过线即阳性。只不过统计学是通过p值来定义显著和非显著性区分阳性、阴性。当然,倍数法更容易操作和计算。不过,正如倍数法是人为设定的规则,没有内在生物学意义一样,统计学方法计算的本质是认为二者没有差异的可能性小于1/20(以p≤0.05为例)。p=0.052和p=0.049,从统计学角度会给出一个化合物阴性、阳性的结论,但其实二者之间没有生物学意义的差异,很可能是皿间变异引起。另外,采用不同统计学方法可以得出不同的结论,正如不同实验室采用不同的倍数界定阳性、阴性一样。目前为止,披露的统计学方法有很多,如Margolin et al., 1981;Myers et al., 1981; Stead et al., 1981; Bernstein et al., 1982; Snee & Irr,1984; Krewski et al., 1993; Mahon et al., 1989; Leroux & Krewski, 1993;Edler, 1992; Kim &Margolin, 1999。但是,都没有得到广泛使用。可能与倍数法更容易使用,不需要专业统计软件有关,也可能与倍数法对于一些菌株如TA100、TA98更保守有关,亦或者与监管机构更熟悉倍数法有关。
超过历史背景对照
除了满足倍数规则或统计显著性之外,建议阳性反应应该超出历史背景对照范围或者分布的上限,可以参考OECD 2014a No.473、OECD 2014a No.474、OECD 2017。历史对照的上限可以根据95%置信区间确定,也可以采用2或3倍SD设定。
历史对照也有其局限性,每个实验室的菌株来源可能不同、S9批次不同、琼脂和试剂的批号及用量不同、孵育温度和时间不同、操作人员不同等均对克隆计数造成影响。尽管如此,相较于平行设置的溶媒对照,历史对照似乎更受重视。但实际上,就具体试验而言,平行开展的溶媒对照数据更相关。
所以,在评估Ames试验结果时,历史对照数据不应该被赋予与同时对照同等或更高的权重,而应该更多地作为评估试验本身是否可接受的工具。
综合以上方法
2019年,Levy等人提出可以将倍数法、统计学方法、历史对照三种方法联合使用。对于明确的阳性反应,需要同时满足以上三种标准。反之,阴性反应,则三种方法均是阴性方可。其它情况,则视为可能阳性、可能阴性或不确定性。不过,这个方法并没有达成共识。其实还是涉及到每种方法如何界定阳性、阴性的问题。
专家判断
专家判断的本质是基于主观的个人经验和偏见(based on the data reviewer's biases and experience)。但是专家判断这种主观方法也有一定的应用场景,比如某些反应相对较弱但可重复,且与浓度相关,但没有达到一个令人信服的水平以将其定为致突变物,可以通过专家判断是否应该定为致突变的不确定结论。又比如某些化合物的致突变反应仅限于单一浓度,或结果不可重复的情况。但是,即使同一个实验室的不同人员对同样数据也可能得出不同结论,更何况来自不同实验室的人员。所以,阳性反应的可重复性,专家盲审,可以增强结果的可信度和一致性。
Ames阳性判定方法讨论
Ames遗传毒性测试结果的重要性不言而喻,很多情况下能左右一个化合物的命运。但纵观各种Ames阳性判定方法,很难界定哪些反应是真正具有生物学意义的阳性反应,哪些反应虽然超过对照水平但并无实际意义。无论实验室如何定义“生物学相关性”,都难以确定一个明确的界限来区分哪些反应是真正具有生物学意义的阳性反应。这也是Ames试验的难点所在,虽然FDA和OECD均将生物学层面的相关性置于首位,但何谓生物学相关却未给出明确定义。虽然大部分试验结果不难判定,总有些试验受试物菌落数增加但又达不到实验室拟定的阳性判定标准,这时可能会有多种其它方法供选择,而采用不同路径得到的结果却又不同。对于这类无法明确阳性或阴性的情况,最好对试验进行重复,或者采用相同方案,或者对试验方法进行改进(如受试物浓度间距调整)。这点在ICH S2(R1)有过类似描述,“最理想的是试验能得到明确的阳性或阴性结果。但是,试验结果有时达不到预先设定的阳性或阴性结果的判定标准,因此被定为可疑或不确定。统计学方法的应用有助于数据分析。但是,充分的生物学意义分析是至关重要的。对可疑结果进行重复试验,可得到1)一个明确的阳性结果,因此总体结果为阳性;2)一个阴性结果,所以可疑结果缺乏重现性,总体结果为阴性;3)另一个可疑的结果,最后结论仍维持可疑。
Ames阳性的后续处理
ICH S2(R1)中指出,大量回顾研究显示许多在Ames试验中检出为致突变剂的化合物是啮齿类动物致癌剂。NMPA《药物遗传毒性研究技术指导原则》也指出Ames试验能检出相关的遗传学改变和大部分啮齿类动物和人类的遗传毒性致癌剂。
以上两个指南均提到,当Ames试验结果阳性时,提示受试物具有DNA反应性,为评估患者用药的潜在风险,需进行广泛的追加试验评价体内致突变和致癌性潜力,除非通过适当的风险-获益分析证明是合理的。另外,应对阳性结果进行分析,比如受试物纯度,以确定阳性结果是否污染物所致。又如氨基酸污染也会导致菌落数升高,出现假阳性结果,所以Ames试验不适合检测可能会降解的肽类。还有一种情况是阳性结果不具备人体遗传毒性潜力,例如发生细菌特异性代谢(如通过细菌硝基还原酶活化)。
FDA提出,当遗传毒性结果为阳性时,对进入临床试验是否安全,FDA会考虑所有的安全性资料。这些考虑包括对所有遗传毒性资料的全面彻底的评价和拟进行的临床试验的性质。如果这些遗传毒性试验的结果提示无潜在的遗传毒性,临床研究一般可在健康受试者和拟用临床适应症的病人中进行。若出现明确的阳性结果,需要提供有关遗传毒性机制的证据以及这种机制与预期体内暴露的相关性,或者排除DNA作用机制。

来源:药理毒理开发


