您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-07-30 09:47
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
拜耳“广谱”抗癌药Vitrakvi即将欧盟上市。拜耳(Bayer)公司首创的口服TRK抑制剂Vitrakvi(larotrectinib)获欧洲药管局人用医药产品委员会(CHMP)推荐批准,用于肿瘤中存在神经营养受体酪氨酸激酶(NTRK)基因融合的儿童和成人实体瘤患者。来自成人患者I期临床、成人和儿科患者II期NAVIGATE研究等多项临床汇总数据显示,Vitrakvi治疗表现出高比例、持久且快速的缓解。主要分析显示,总缓解率(ORR)为72%(95%CI:62,81),其中完全缓解率(CR)为16%、部分缓解率(PR)为55%。临床不良事件(AE)大多数为1级或2级。
国内药讯
1.赛默罗生物在研新药首例受试者给药。赛默罗生物在研创新药SR419正式启动澳大利亚Ⅰ期临床,完成首例受试者入组并给药。SR419是由赛默罗生物自主研发并具有全新机制的外周神经病理痛候选治疗药物,也是赛默罗生物首个进入临床开发阶段的候选药物。该研究旨在评估SR419在健康受试者中的安全性、耐受性和药代动力学特征。
2.科伦药业乙肝新药KL060332胶囊获批临床。科伦药业旗下创新药物KL060332胶囊获国家药监局临床批件。KL060332胶囊是科伦药业开发的具有自主知识产权的乙肝病毒核衣壳组装调节剂,拟用于慢性乙型肝炎的治疗。非临床研究数据表明KL060332胶囊可高效、广谱抑制各基因型乙肝病毒增殖,并具良好的药代动力学属性和安全性,单药或与已有的治疗慢性乙型肝炎的药物联用有望提升慢性乙型肝炎临床治疗理想终点达标率。目前全球尚无同机制药物获批上市。
3.必贝特医药肺癌1类新药BEBT-109获临床批件。必贝特医药自主研发的拟用于治疗非小细胞肺癌的1类新药BEBT-109胶囊获国家药监局临床批件。BEBT-109是第三代表皮生长因子受体(EGFR)抑制剂奥希替尼化学结构类创新药物,也是必贝特医药研发进入临床试验的第三个抗肿瘤国家1类新药,其化合物发明专利己经在中国授权,PCT国际发明专利已在四十多个国家申请授权。
4.凯茂生物重组人促红素-HyFc融合蛋白注射液获批临床。复星医药控股子公司凯茂生物重组人促红素-HyFc融合蛋白注射液获国家药监局批准,即将开展用于治疗肾性贫血的Ⅰ期临床。重组人促红素-HyFc融合蛋白注射液由Genexine公司开发,凯茂生物通过授权获得其在中国境内的独家开发、注册、上市等权益。该新药为长效重组人促红素产品,目前,已在全球上市的长效重组人促红素产品为 Amgen公司的 Aranesp®和罗氏的 Mircera®, 国内尚无长效重组人促红素产品上市。
5.科伦药业注射用 SKB264临床申请获FDA受理。科伦药业控股子公司KLUS 公司抗体偶联药物(ADC)注射用SKB264的临床申请获FDA受理。注射用SKB264是靶向肿瘤细胞高表达抗原的ADC药物,其偶联方式和毒素小分子具有自主知识产权,拟用于恶性肿瘤治疗。临床前研究显示,该新药在靶点阳性的乳腺癌、胃癌、肺癌、结直肠癌等动物肿瘤模型中的抗肿瘤活性显著,兼具良好的安全性和耐受性。目前全球尚无该靶点的药物获批上市。
6.海创药业完成4000万美元B轮融资。海创药业完成4000万美元的B轮融资。本轮融资由通德资本、复星医药领投。海创药业是一家专注于创新药物研究和产业化的国家高新技术企业。目前,该公司拥有8个品种的新药产品管线,涵盖多种癌症、代谢疾病等领域。其中,前列腺癌症新药HC-1119已启动全球多中心Ⅲ期临床试验,高尿酸血症/痛风新药HP501已进入中国Ⅰ期临床。此次融资该公司将继续推进HC-1119的Ⅲ期临床、HP501的Ⅰ/Ⅱ期临床及其他产品研究。
国际药讯
1.首个吸入性左旋多巴产品Inbrija获CHMP推荐批准。Acorda 公司左旋多巴吸入粉Inbrija获欧洲药管局人用医药产品委员会(CHMP)推荐批准,用于正在接受左旋多巴/多巴脱羧酶抑制剂(如卡比多巴)治疗的帕金森病患者关闭期(OFF)的间歇性治疗。Inbrija此前已获FDA批准用于该适应症的治疗,该药也是唯一一个获监管批准的吸入性左旋多巴。一项III期临床SPANSM-PD(NCT02240030)数据显示,与安慰剂组相比,Inbrija 84mg组给药后30分钟评估的帕金森病评分量表(UPDRS)运功评分的平均变化具统计学意义的显著改善(-9.83分 vs -5.91分,p=0.0088),达主要终点以及多个关键次要终点。
2.杨森双特异拮抗剂Stelara新适应症获CHMP推荐批准。杨森公司IL-12/23抑制剂Stelara(ustekinumab)的扩展适应症申请获欧洲药品管理局人用药品委员会(CHMP)推荐批准,用于治疗对常规疗法或生物制剂反应不足或不耐受的中重度活动性溃疡性结肠炎(UC)成人患者。一项Ⅲ期临床UNIFI结果显示,在接受诱导治疗第2周,Stelara组患者中没有肠道出血或大便频率正常的患者比例高于安慰剂组;62%的Stelara组患者在第8周获临床缓解,安慰剂组这一数值为31%(p<0.001);在随后为期44周的维持治疗结果表明,接受Stelara维持疗法的患者中达临床缓解的比例显著高于对照组。
3.默沙东创新抗病毒组合疗法Ⅱa期临床结果积极。默沙东创新核苷类逆转录酶易位抑制剂(NRTTI)islatravir与其它抗病毒药物联用一线治疗HIV-1感染患者的Ⅱa期临床结果积极。在临床试验中,未接受过抗病毒疗法治疗的HIV感染成年患者接受islatravir、doravirine、和lamivudine构成的组合疗法治疗,24周之后,患者接受由islatravir和doravirine构成的双联维持疗法。试验结果表明,islatravir构成的组合疗法对病毒活性的控制水平与已获批的Delstrigo组合疗法相当,并表现出良好的耐受性和安全性。
4.创新酶替代疗法获突破性疗法认定。Aeglea BioTherapeutics在研酶替代疗法pegzilarginase获FDA授予突破性疗法认定,用于治疗精氨酸酶缺乏症(ARG1-D)。Pegzilarginase是一种增强型的人体精氨酸酶,可促进体内精氨酸代谢。Ⅰ/Ⅱ期临床及Ⅱ期开放标签扩展试验数据表明,pegzilarginase给药后患者的血液精氨酸水平降低并维持稳定。Aeglea公司计划开展关键性的Ⅲ期临床试验,评估pegzilarginase与安慰剂相比的疗效。
5.FDA要求艾尔建全球召回其乳房植入物。据FDA要求,艾尔建日前在全球范围内召回其Biocell毛面乳房植入物。FDA最新数据显示,该植入物与乳房假体相关的间变性大细胞淋巴瘤(BIA-ALCL)直接相关。在统计的573例BIA-ALCL患者中有 481(80%)例植入了艾尔建的 Biocell 乳房植入物,目前573例患者中33例死亡。使用艾尔建植入物的患病风险估计是其他纹理植入物的6倍。目前,艾尔建已在涉及的所有市场中停止销售BIOCELL 毛面乳房植入物和组织扩张器,同时将指导医生退回尚未使用的产品。不过,FDA与其他卫生部门不建议在无症状患者中移除或更换这款乳房假体产品。
医药热点
1.两部门:建设医联体不得变相取消中医医院。国家卫健委和中医药管理局联合发布《关于在医疗联合体建设中切实加强中医药工作的通知》,强调中医药工作的重要性。《通知》指出,要切实履行政府举办公立中医医院主体责任和投入责任,在医联体建设过程中,不得变相地取消、合并中医医院,不得改变其功能定位,不得以各种理由在事实上削弱中医医院建设。
2.北医三院:多囊卵巢综合征研究获新进展。国际权威学术期刊《自然医学》(Nature Medicine,IF:30.641)近日在线发表了北京大学第三医院乔杰院士团队与北京大学医学部基础医学院姜长涛研究员团队的合作研究成果。该研究以肠道菌代谢产物调控机体肠道免疫的机制研究为切入点,深入探讨肠道菌—胆汁酸—IL22轴在PCOS发病中的关键作用。阐明了肠道菌与胆汁酸调控肠道ILC3细胞分泌IL-22的新机制,为防治PCOS提供了新视角。
3.中国每千名儿童拥有0.92名医生。国家儿童医学中心近日对外发布我国儿童医疗卫生服务发展最新情况。数据显示,截至2018年,我国拥有儿科医师23万,与2017年的15.4万相比增加不少。每千名儿童的儿科执业(助理)医师数为0.92人(即每千名儿童拥有0.92名儿科医生)。国家儿童医学中心主任倪鑫表示,“尽管离发达国家如美国每千名儿科执业(助理)医师1.5人的标准还有差距,但我国儿童医疗供需矛盾近年有了明显缓解。”2018年,我国共有儿童医院228家,开设儿科的综合医院2万余家,每千名儿童床位数为2.22张。
股市资讯
.
上个交易日 A 股医药板块 -0.60%
涨幅前三 跌幅前三
司 太 立 +10.01% 辅仁药业 -10.05%
兴齐眼药 +10.00% 金浦钛业 -6.92%
昆药集团 +5.64% *S T 仰帆 -5.02%
【众生药业】子公司广东众生睿创生物科技有限公司收到发明专利证书,发明名称为羟基嘌呤类化合物及其应用。
【达安基因】发布业绩快报,实现营业总收入5.16亿元,同比下降35.87%;归母净利润约6051.46万元,同比增长1.61%。
【透景生命】公司拟向3名原激励对象回购其已获授但尚未解除限售的全部限制性股票22,680股并予以注销,回购金额合计为人民币723,362.33元。
审评动向
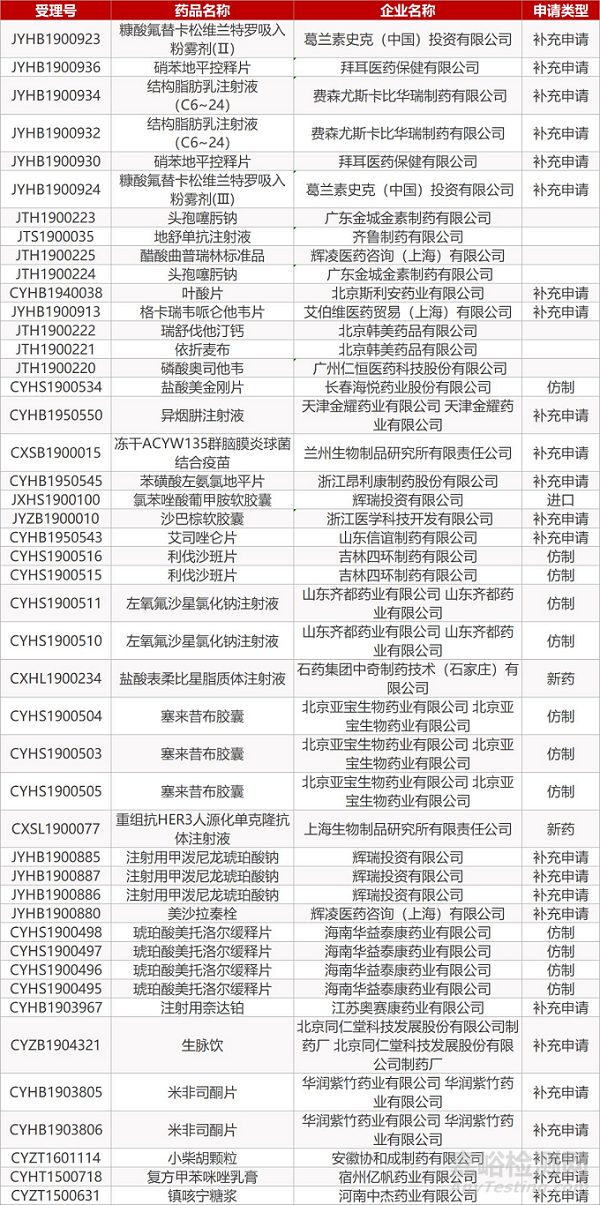
1. CDE最新受理情况(07月29日)
2. FDA最新获批情况(北美07月28日)
暂无

来源:药研发


