您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-06 09:01
溶瘤病毒能抗肿瘤很多人多少都能理解一些。细菌用于肿瘤治疗,熟悉的朋友相对少很多。但实际上,肿瘤内部是有细菌存在的,而且细菌并不是作为旁观者无所作为,而是对肿瘤的发展、肿瘤微环境(TME)的调节发挥着重要作用。当然,细菌也有好坏之分,有的促瘤,有的则抑瘤。
活菌用于肿瘤免疫治疗研究已有数十年。活菌的治疗特点有别于其它抗肿瘤药物,比如可以选择性靶向肿瘤组织、可以到达肿瘤深处、可实现指数级增长,并能重塑肿瘤微环境,实现“冷肿瘤”向“热肿瘤”的转变。此外,细菌还可以进行工程改造,优化其抗肿瘤能力。
本文重点介绍下TME中细菌的特点、功能,在肿瘤进展和抑制中的作用,及临床在研活菌产品等。
肿瘤内活菌-肿瘤相互作用
严格讲,肿瘤内细菌的起源还不清楚。有三个可能的途径。一是器官内的粘膜屏障在肿瘤形成过程中被破坏,使细菌得以进入肿瘤。二是考虑到肿瘤内的细菌与所在组织的细菌谱很相似,有可能在肿瘤产生之前,细菌已经在组织中存在。三是通过口腔、胃肠道系统或其它部位进入血液,随血液移行,并最终从受损的脉管系统定植在肿瘤部位。
细菌促进肿瘤产生及进展
细菌通过多种机制促进肿瘤形成和/或进展。如下图所示,细菌可以通过影响宿主细胞基因组稳定性促进肿瘤形成,如分泌小分子基因毒素,引起DNA破坏和突变。细菌的效应分子和粘附素可激活促瘤信号通路。细菌还可以导致持续的慢性炎症反应,为肿瘤形成创造条件。此外,细菌还可以结合NK和T细胞表面的抑制性免疫检查点受体。
细菌抑瘤机制
细菌发挥促瘤还是抑瘤作用,很大程度上取决于菌株类型,不同细菌的表现区别很大。如下表所示,当胰腺癌中富含假黄单胞菌(Pseudoxanthomonas,)、链霉菌(Streptomyces)、糖多孢菌(Saccharopolyspora)、克劳氏芽孢杆菌(Bacillus clausii)时,患者往往具备较长的生存期。有趣的是,将胰腺癌长生存期个体内的胃肠道菌群移植到其它小鼠后,同样会增强CD8+T细胞介导的抗肿瘤免疫反应。间接说明,瘤内细菌与胃肠道微生物之间有密切联系。当然,细菌增强免疫的机制很多,有的细菌可以激活T和NK细胞的STING通路,增加DC细胞的抗原递呈。有的则可以增加CD8+T细胞在肿瘤细胞中的浸润。
还有一点比较有意思。肿瘤会不停的异常表达一些抗原,有些是正常组织表达,但肿瘤表达更高的抗原。有些则是正常组织压根不表达,肿瘤特异性表达的抗原。瘤内细菌会表达一些与肿瘤抗原表位相同的多肽,而且不只序列一样,甚至结构和构象也相似。这就无形中增加了抗肿瘤免疫,因为有些针对抗菌的CD8+T细胞,同样会交叉杀伤肿瘤细胞。
有些细菌还会影响现有肿瘤治疗药物的药效。比如胰腺癌患者中,瘤内γ-变形杆菌通过表达胞苷脱氨酶使吉西他滨失活,降低该药物的药效。伴放线聚集杆菌也同样会促进吉西他滨耐药。结肠癌患者中,瘤内核梭杆菌通过选择性下调miR-4802下游TLR-4-MYD88信号通路,诱导自噬,导致5-氟尿嘧啶和奥沙利铂的耐药。所以,临床通过给予抗生素治疗,抑制这些菌群的作用,会增强很多抗肿瘤药物的治疗效果。
活菌用于肿瘤的治疗
了解完细菌的一些作用,再看下工业界如何利用天然活菌或者基因改造菌探索抗肿瘤应用的。
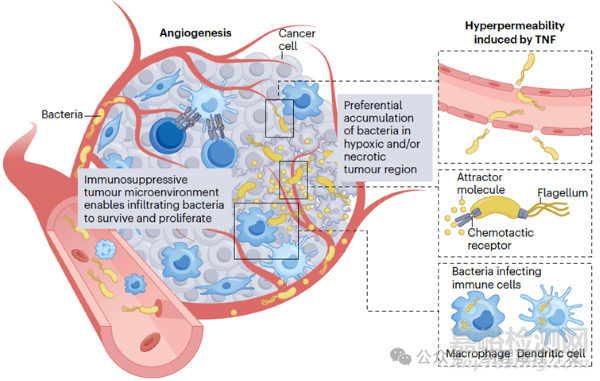
细菌经系统途径给药后,在血液及网状内皮系统中浓度较高,之后数小时至数天内,被快速清除。但细菌也有其独门绝技,可以选择性靶向和定植在肿瘤中。如下图所示,细菌可以通过血管,在肿瘤部位渗透到微环境中。但细菌的渗透不像其他分子,多以被动扩散为主。细菌是通过识别死亡肿瘤细胞释放的分子,主动趋化进入肿瘤深处的。一旦在肿瘤定植后,细菌开始增殖。那细菌在非肿瘤组织也会增殖吗?其实,很多细菌在肿瘤部位蓄积比例更高,以沙门氏菌为例,肿瘤和非肿瘤部位的比例是10000:1。其中一个原因是,肿瘤微环境是免疫抑制的,对细菌其实也是一种保护,有利于其生存。但细菌也不会无限繁殖,中性粒细胞和巨噬细胞会将其限制在一定范围和区域。不过,如果机体中性粒细胞或巨噬细胞被耗竭,瘤内细菌就会毫无约束的扩散。
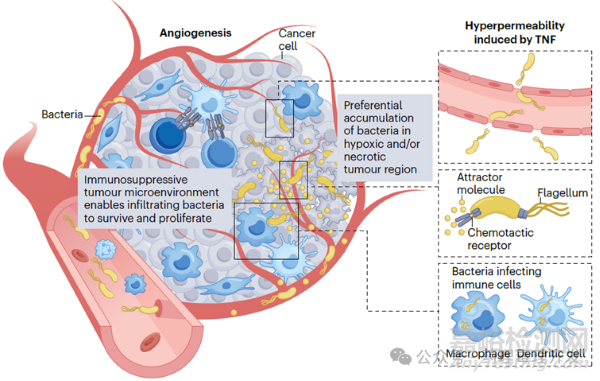
治疗性细菌的作用机制
细菌可以直接杀伤肿瘤细胞。一是通过抢营养。无论肿瘤还是细菌,都是活体,都需要肿瘤微环境中的营养维持存活,细菌可以耗竭营养,导致肿瘤细胞死亡。另外,有些细菌如沙门氏菌,可以诱导肿瘤细胞凋亡和自噬。还有些细菌鞭毛成分能直接通过激活TLR5,抑制肿瘤细胞生长。李斯特菌通过增加肿瘤细胞内活性氧水平,产生直接细胞毒作用。
另外,细菌是可以进行工程改造的。通过改造,可以让细菌表达一些具有细胞毒类作用的分子,比如cytolysin A、listeriolysin O、FAS ligand、TRAIL、TNF、Tum-5等,可以直接抑制肿瘤生长。还有些改造思路也挺有意思,细菌体内转入可以将前药转化为活性代谢产物的酶,比如将5-氟胞嘧啶转化为5-氟尿嘧啶,可以降低化疗药物的毒性,增强肿瘤部位的选择性杀伤。细菌在肿瘤内的靶向定植其实为靶向递送提供了很多发挥空间,除了刚才说的这些酶、配体,还可以携带其他影响肿瘤生长的元件,比如小RNA,又如一些抗血管(内皮抑素等)因子,通过各种机制抑制肿瘤生长,甚至杀死肿瘤细胞。此外,还可以携带一些免疫调节分子,比如IL-18、IL-2、IL-15、CCL21等,增强NK或CD8+T细胞活性,通过免疫系统杀伤肿瘤。最后,细菌还可以表达一些TAA(肿瘤相关抗原),增强免疫识别能力。细菌的可探索和改造的策略很多,不再一一赘述。
细菌治疗肿瘤的临床研究
分离的菌株
1891年,William Coley采用链球菌治疗骨肉瘤,这是首次记载的将活菌用于肿瘤治疗。不过,虽然看到肿瘤抑制效果,也有患者出现感染导致的死亡。后来,Coley开发了粘质沙雷氏菌和化脓性链球菌混合物,经加热灭活后,给予肿瘤患者,称为“Coley toxin”,患者生存期得以延长(8.9年vs 7.0年),但药效只能说是中等。另外一个采用细菌产品治疗肿瘤的成功案例就是减毒的BCG(卡介菌,一种牛分枝杆菌)用于治疗非肌层浸润性膀胱癌,于1990年获FDA批准上市。
进入2000年以后,肿瘤治疗细菌产品的临床研究逐渐增多。
鼠伤寒沙门氏菌VNP20009治疗转移性黑色素瘤的Ⅰ期临床试验,虽然看到菌血症的DLT反应,但总体安全性表现尚可,可惜的是虽然看到一些促炎因子的释放及细菌的肿瘤定植迹象,但未见肿瘤出现缓解。
2023年披露的一项编码IL-2的鼠伤寒沙门氏菌产品,与FLOFIRINOX(奥沙利铂、盐酸伊立替康、氟尿嘧啶、亚叶酸钙化疗组合)联用治疗转移性胰腺癌,20例患者的中位总生存期明显延长,是历史对照数据的2倍(24个月vs11.1或13.1个月)。
C. novyi-NT是一款减毒的诺维氏梭状芽胞杆菌,不表达alpha毒素,可以在肿瘤内的厌氧环境中复制。动物试验中可看到裂解肿瘤细胞和引起炎症反应的作用。临床Ⅰ期研究中,瘤内注射,治疗晚期实体瘤,24例患者中,42%患者看到肿瘤裂解和肿瘤负荷降低。2例患者出现4级脓毒症,1例患者出现4级气性坏疽的DLT。目前正在开展与PD-1抗体pembrolizumab联用的Ⅰ期试验(NCT03435952),首例入组的患者已经看到缓解。
李斯特菌也是临床研究比较多的活菌之一。一项Ⅱ期临床研究,CRS-207(一款分泌间皮素的改造的李斯特菌)与胰腺癌疫苗GVAX和环磷酰胺联用可延长94例经治转移性胰腺癌患者的生存期,且毒性较小。另外一项Ⅱ期临床研究,在CRS207+GVAX+环磷酰胺组合基础上,加上PD-1抗体nivolumab,93例转移性胰腺癌患者,肿瘤微环境可看到CD8+T细胞扩增,肿瘤相关巨噬细胞和髓系细胞减少。不过,与不加nivolumab相比,并未见客观缓解率和生存期的改善。CRS-207与培美曲塞和顺铂联用治疗恶性胸膜间皮瘤的Ⅰb期临床试验,也看到了肿瘤内T细胞扩增、CD8+T/Treg比例增加,DC和NK细胞浸润增加,免疫抑制性M2巨噬细胞向M1转化,但Ⅱ期临床未见明显获益。ADXS-HPV也是一款改造的李斯特菌,可以分泌融合TAA(HPV16的E7抗原肽)的LLO,在一项宫颈癌Ⅱ期临床中看到了不错的耐受性和有效率。后续启动了与化放疗联用治疗高风险局部晚期宫颈癌Ⅲ期临床试验。不过试验已经终止,原因不明。ADXS-502是一株表达22种NSCLC相关抗原的李斯特菌,与pembrolizumab联用,在鳞状和非鳞NSCLC中看到了46%-67%的疾病控制率。JNJ-6404757也是一款表达间皮素的李斯特菌,Ⅰ期临床与nivolumab联用,大部分毒性表现为轻微发热和寒战,另有2/12例患者出现致命的肺炎。后续未见该产品开展进一步临床研究。
可以看到,大部分活菌抗肿瘤产品临床主要与免疫检查点抑制剂联用。主要原因是细菌可通过递送TAA或免疫调节剂,帮助重塑肿瘤微环境。不过,目前临床数据大多还源自早期临床,更大样本量的研究还在进行中。
粪便移植(Faecal microbiota transplantation, FMT)
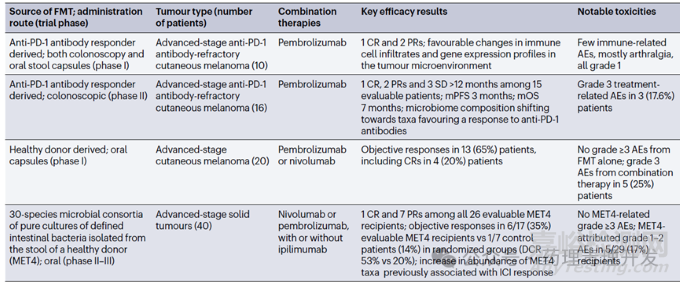
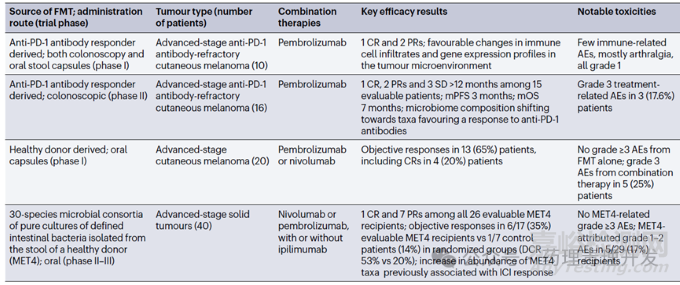
粪便移植咋一听不怎么雅观,或者有些离奇。但实际上,胃肠道微生物菌群可以影响肿瘤患者的免疫反应,并作为免疫治疗的一种方案正在开展临床研究。FMT是一组混合菌群,移植后会出现优势菌群。肠道微生物组分析显示,对FMT移植有应答的黑色素瘤患者,移植后体内富集程度最高的是厚壁菌门和放线菌门,拟杆菌门减少。FMT目前没有太多积极的临床数据披露。
FMT也有很多局限性,包括安全性问题,及因供体/受体等菌群标准化挑战带来的应用受限,广泛推广和普适性有难度。为克服这一问题,有团队发明了一种有健康人粪便样本纯化得到的由30种不同细菌组成的菌群,Microbial Ecosystem Therapeutic 4(MET4),作为肠道微生物菌群移植的替代物。临床数据显示,MET4与免疫检查点抑制剂联用治疗晚期实体瘤,观察到比免疫检查点单药更好的药效。FMT在研临床试验及结果如下表所示。
最后
抗肿瘤药物的形式非常多样。细菌这类活体其实在肿瘤治疗方面的探索已经100多年。虽然一度进展缓慢,但2000年以后临床研究逐渐增多。目前虽然上市的活菌类产品很少,但临床试验却是很多,主要是与PD-1抗体联用。活菌类产品面临的主要挑战也很多,一是作用机制不清晰,更多的是对免疫的多方面影响,如果能确定主导机制,会更有利于这类产品的开发。二是不良反应比较多。即使是减毒的细菌,依然不可避免出现一些毒性反应,比如感染,尤其是与免疫抑制化疗药物联用,这一风险更高。三是活菌类药物的药代动力学与其它传统治疗药物很不同。活菌类药物的有效性取决于在靶部位的增殖,而不是给药剂量。四是活菌类药物不能通过传统的加热或过滤手段去除不想要的病原体,这就为GMP临床批样品的生产带来很大挑战。作为一种新型活的生物体类治疗药物,还有很多来自监管的挑战,需要跟监管机构就样品的生产、质控、非临床研究等进行密切沟通。

来源:药理毒理开发


