您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-10-24 08:41
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
渤健阿尔茨海默病治疗药物计划明年申报上市。渤健(Biogen)和卫材(Eisai)联合宣布,在与FDA和外部专家讨论之后,计划明年递交阿尔茨海默病治疗药物aducanumab的上市申请。aducanumab是一种与β淀粉样蛋白结合的人源单克隆抗体,此前曾因独立数据监督委员会对其Ⅲ期试验中期数据的无效性分析结论而被终止临床试验。此后渤健对试验数据集进行全面分析后发现,EMERGE研究中剂量为10 mg/kg的aducanumab能够显著改善AD患者认知能力;ENGAGE研究中持续接受剂量为10 mg/kg的aducanumab的部分AD患者的认知能力也得到提高。基于这些发现,渤健和卫材决定重启对aducanumab的申请程序。如果此次提交获得批准,aducanumab将成为延缓阿尔茨海默病临床症状,以及证明去除Aβ蛋白可带来更好临床结果的首个疗法。
国内药讯
1.亚宝生物甲苯磺酸索拉非尼片上市申请获受理。据米内网数据,亚宝生物按仿制药4类申报上市的甲苯磺酸索拉非尼片获国家药监局受理。甲苯磺酸索拉非尼片为多激酶抑制剂,该药原研药由拜耳研发,已获FDA批准用于一线治疗晚期肾癌以及用于治疗无法切除的肝细胞癌。2008年7月该原研产品获批进口中国,目前国内市场上仅原研产品上市销售,3家仿制药企业提交上市申请。2018年该产品中国公立医疗机构终端的销售额为10.3亿元。
2.亿帆医药创新生物药获孤儿药资格认证。亿帆医药旗下上海健能隆的重组人白介素22-Fc融合蛋白(F-652)获FDA授予治疗“急性移植物抗宿主病”的孤儿药资格。F-652项目是利用基因工程技术通过CHO细胞表达的重组人白细胞介素22-Fc(IgG2)融合蛋白,是上海健能隆拥有自主知识产权的全球首创(1类创新)生物药。目前F-652已完成在美国开展急性移植物抗宿主病和急性酒精性肝炎两个适应症的IIa期临床试验,以及已完成在中国开展的急性胰腺炎适应症的Ia期临床试验,临床试验均达预设目标。
3.石药Cx43抗体新药即将在澳大利亚启动临床试验。石药集团宣布,其附属公司AlaMab即将在澳大利亚启动其用于治疗急性脊髓损伤的在研新药ALMB-0166的首次人体临床试验。ALMB-0166是一种靶向Cx43半通道膜蛋白的同类首创(First-in-class)人源化抗体药,由AlaMab自主研发用于治疗急性脊髓损伤,缺血性中风及其它多种临床急需的神经性疾病。该药2018年已获FDA授予用于治疗急性脊髓损伤的孤儿药资格,日前也刚获FDA的罕见儿童疾病资格认定。AlaMab还计划在中国及美国等国家启动ALMB-0166的相关临床研究。
4.浙江医药牵手Ambrx研发ADC药物。浙江医药旗下新码生物与Ambrx公司就在研抗体偶联药物ARX305签署合作开发和许可协议。Ambrx公司是由厚朴等中国基金公司控股的一家生物制药公司,专注于利用遗传密码扩展技术开发抗体偶联药物(ADC)、免疫调节蛋白、双特异性抗体等生物药。Ambrx公司开发的ARX305拟用于治疗肾细胞癌、非霍奇金淋巴瘤等CD70阳性肿瘤。根据协议,新码生物将获ARX305在中国区域内独家开发和商业化权益,并负责为该产品I期临床结束之前的全球开发活动提供资金;Ambrx公司有权获该产品在中国的销售提成(按净销售额的10%-15%提取权益金)。
5.腾盛博药与Qpex合作开发β-内酰胺酶抑制剂。Qpex Biopharma宣布,就其治疗多重性耐药革兰氏阴性菌感染的3款在研疗法(OMNIvance、ORAvance和下一代多粘菌素),与腾盛博药在大中华地区达成合作协议。研究表明β-内酰胺酶使得细菌对青霉素类抗生素产生耐药性,Qpex致力于开发β-内酰胺酶抑制剂(BLI)(含有不常用的硼元素),旨在通过单药或组合使用来对抗不同情况下的多重耐药菌感染。OMNIvance和ORAvance使用了Qpex的新型超广谱BLI QPX7728,来抑制丝氨酸和金属β-内酰胺酶,它能恢复多种静脉和口服β-内酰胺抗生素对耐药性革兰氏阴性菌的疗效。
6.泽生科技拟赴科创板上市。泽生科技拟申请在科创板IPO,目前正处于上市前的辅导阶段。泽生科技是一家致力于研发治疗器官衰竭等重大疾病的创新药物和产品的生物医药公司,在中美两地均有运营。目前该公司研发管线上有四款在研新药,正在开发用于治疗心衰、阿尔茨海默病、尿路感染等疾病。其中,该公司首款自主研发的纽卡定(重组人纽兰格林)是一款潜在的first-in-class新药,今年8月,该新药已获FDA授予治疗慢性心衰的快速通道资格。目前该新药的有条件上市申请也已获国家药监局纳入优先审评。
国际药讯
1.BMS公司PD-1组合疗法治疗肺癌Ⅲ期结果积极。BMS公司开发的PD-1抑制剂Opdivo(nivolumab)与低剂量的CTLA-4抑制剂Yervoy(ipilimumab)联用,结合化疗一线治疗非小细胞肺癌(NSCLC)的关键性Ⅲ期试验CheckMate-9LA达主要终点。与化疗相比,该组合疗法联合化疗显著提高NSCLC患者(无论PD-L1是否表达)的总生存期(OS)。详细数据将于未来的医学会议上公布。该组合疗法此前已获FDA批准一线治疗中高度风险的晚期肾细胞癌患者,以及经治高微卫星不稳定性(MSI-H)或错配修复缺陷型(dMMR)转移性结直肠癌患者。
2.Trovagene公司PLK抑制剂临床结果积极。Trovagene公司第三代口服PLK1抑制剂onvansertib(PCM-075)与Folfiri、Avastin(bevacizumab)联用二线治疗携带KRAS基因突变的转移性结直肠癌(CRC)的Ⅰb/Ⅱ期临床获积极数据。在第一批患者的分析中,观察到肿瘤KRAS基因突变负荷水平的降低。PLK1是Polo样激酶家族成员之一,在乳腺癌、前列腺癌和直肠癌等多种实体瘤和血液癌症中高表达。临床前试验表明,onvansertib与HDAC抑制剂等其它疗法联用时可产生协同效应,可用于治疗白血病和多种实体瘤。目前,onvansertib还在临床试验中治疗转移性去势抵抗性前列腺癌(mCRPC)和难治性急性骨髓性白血病(AML)。
3.强生Opsumit联合他达拉非IV期临床达主要终点。强生旗下杨森医药子公司爱可泰隆(Actelion)公布IV期OPTIMA研究的积极数据。该研究评估其已获批的双效内皮素受体拮抗剂Opsumit(macitentan)与PDE5抑制剂他达拉非(tadalafil)联合作为初始口服治疗方案,用于新诊断的肺动脉高压(PAH)患者的疗效。结果显示,在治疗第16周,PAH患者平均肺血管阻力(PVR)主要终点较基线水平下降47%(第16周与基线比值的几何平均值为0.53;95%CI:0.47,0.59)。此外,结果还显示血流动力学改善、功能参数改善(包括6分钟步行距离)、风险状况改善。安全性和耐受性结果与支持批准和使用Opsumit 10mg每日一次的先前临床试验一致。
4.诺华哮喘新药fevipiprant Ⅲ期临床失败。诺华在研DP2拮抗剂fevipiprant治疗哮喘的两项Ⅲ期临床(ZEAL 1和ZEAL 2)结果失败。与安慰剂相比,fevipiprant均未能改善哮喘患者肺功能。诺华并没有进一步说明该药物是否达到次要终点(包括跟踪患者白天哮喘症状评分和生活质量在内的指标)。诺华对该药仍持乐观态度,表示将继续进行评估fevipiprant治疗中重度哮喘急性发作的两项关键性Ⅲ期试验(LUSTER 1和LUSTER 2),结果将于2020年第一季度发布。诺华计划在2020年提交fevipiprant的新药申请。
5.第一三共靶向抗癌药Vanflyta遭CHMP拒绝推荐。第一三共制药第二代FLT3抑制剂Vanflyta(quizartinib)用于治疗复发/难治性FLT3-ITD急性髓性白血病(AML)成人患者的上市申请没有得到欧盟人用医药产品委员会(CHMP)的推荐批准。该药今年6月也遭FDA拒绝批准。quizartinib此前已获FDA授予治疗复发/难治性FLT3-ITD AML的突破性药物资格、治疗复发/难治性AML的快速通道资格。此外,quizartinib在美国、欧盟均被授予治疗AML的孤儿药资格,在日本被授予治疗FLT3突变AML的孤儿药资格。目前该药已获日本厚生劳动省批准上市,这也是该药在全球范围内的首个监管批准。
医药热点
1.三重营养负担困扰全球儿童。联合国儿童基金会发布《2019年世界儿童状况:儿童、食物与营养》报告,分析全球儿童的营养不足问题,并首次提出营养不足的三重负担,相较之前的营养不良和过度肥胖的“双重”负担,又增加了因缺乏必需营养素而引起的隐性饥饿这一项。据最新数据估算,五岁以下儿童中几乎每两个人中就有一人遭受隐性饥饿的困扰。报告指出,全球五岁以下儿童有1.49亿儿童出现生长迟缓,近5000万儿童处于消瘦状态,4000万儿童超重或肥胖。中国儿童营养不足的主要原因是膳食营养不均衡。
2.北京医院启动肺癌诊疗一体化中心。日前,北京医院肺癌诊疗一体化中心正式启动。该中心将建立集早诊早筛、精准诊治、全程关爱为一体的肺癌专病规范化诊疗流程。在早诊早筛方面,患者可一站式完成肺癌的专病挂号多学科专家会诊,以及低剂量CT筛查、精准定位穿刺、病理检查和基因检测。在精准治疗方面,通过多科室专家组成院内及远程多学科会诊专家工作组,为患者打造个性化的治疗方案。在全程关爱方面,通过线上线下活动为患者及家属提供营养护理、康复指导、运动康复知识、心理疏导等服务。
3.重庆:每个区县至少建成1个尘肺病肺康复站。重庆市卫健委日前透露,重庆市规划到2020年底,力争每个区县至少建成1个尘肺病肺康复站,尘肺病患者肺康复建档率达到100%。重庆要求尘肺病肺康复站建设要达到“七个一”的标准,即有一块尘肺病肺康复站标牌、一名经过康复治疗技术培训的医师、一名经过康复护理培训的护理人员、一处康复场所、一组适宜的康复器材、一套康复站职责制度、一套档案。此外,肺康复站可运用中医传统和现代康复技术为尘肺病患者提供康复治疗。
股市资讯
.
上个交易日 A 股医药板块 -1.41%
涨幅前三 跌幅前三
东宝生物 +5.78% 尔康制药 -9.99%
普 莱 柯 +5.39% 通化东宝 -9.54%
方盛制药 +5.03% 丽珠集团 -4.55%
【亿帆医药】《重组人白介素22-Fc融合蛋白作为治疗“急性移植物抗宿主病”的孤儿药申请》获得美国FDA正式认定并获批准。
【桂林三金】2019Q1-Q3实现营业收入11.27亿元(+1.34%),归母净利润3.31亿元(-9.87%),扣非归母净利润3.31亿元(-9.87%);2019Q3实现营业收入3.37亿元(-5.36%),归母净利润0.56亿元(-42.09%),扣非归母净利润0.52亿元(-42.68%)。
【中国医药】公司拟与控股股东中国通用技术(集团)控股有限责任公司共同受让重庆化医控股(集团)公司挂牌转让的重庆医药健康产业有限公司49%的股权,以双方现金出资额比例确定股权比例。本次交易的总出资额为41亿元,其中公司拟出资金额为22.59亿元,受让重庆医药健康27%的股权,将构成关联交易。
审评动向
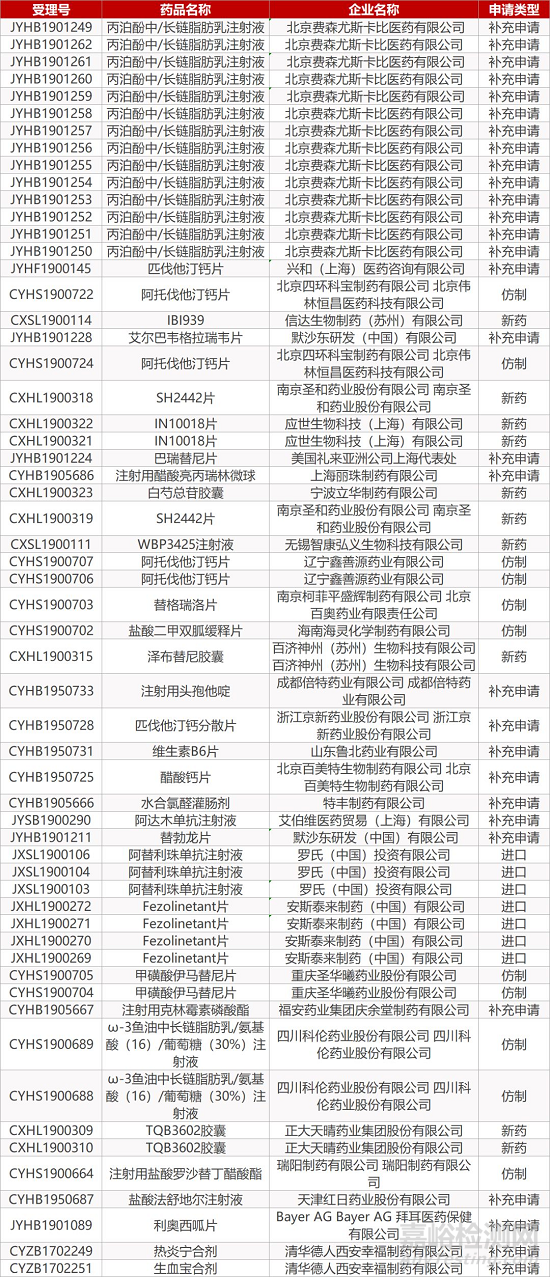
1. CDE最新受理情况(10月23日)
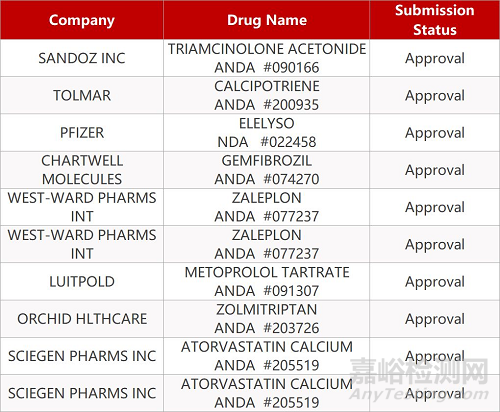
2. FDA最新获批情况(北美10月22日)

来源:药研发