您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-24 09:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
阿斯利康慢阻肺创新三联药物在中国获批。阿斯利康布地格福吸入气雾剂获国家药监局批准,用于慢性阻塞性肺疾病(COPD)患者的维持治疗。布地格福吸入气雾剂是采用创新共悬浮给药技术的三联药物,由布地奈德(吸入糖皮质激素ICS)、格隆溴铵(长效抗胆碱能药物LAMA)和富马酸福莫特罗(长效β2受体激动剂LABA)组成。一项Ⅲ期临床KRONOS结果显示,与双联支气管扩张剂治疗相比,该款三联疗法能为慢阻肺患者带来多重获益:中重度急性加重率降低52%;显著延长到达首次中重度急性加重的时间;起效快速并可持续显著改善患者肺功能,且具有良好的安全性。
国内药讯
1.武田5.1类新药沃诺拉赞获批上市。武田的5.1类新药沃诺拉赞获国家药监局批准上市。富马酸沃诺拉赞是一种钾离子竞争性酸阻滞剂,商品名为 Takecab®,由武田制药和大冢制药联合研发,于2014年12月在日本获批上市,用于治疗酸相关疾病,包括幽门螺杆菌感染、胃食管返流、消化性溃疡、十二指肠溃疡、胃溃疡以及食管炎。Insight数据库显示,沃诺拉赞片剂国内共有25家药企仿制药在研,其中中美华东、瑞阳制药和北京诺和等5家仿制药处在临床试验中。
2.修美乐在华获批第四个适应症。艾伯维宣布,NMPA已批准修美乐®(阿达木单抗注射液)用于治疗多关节型幼年特发性关节炎(pJIA)。这也是修美乐®在华获批的第四个适应症。修美乐®是中国首个获批可以用于治疗pJIA的全人源单克隆抗体,截至目前,修美乐®已获批的四个适应症分别为:类风湿关节炎、强直性脊柱炎、中重度斑块状银屑病以及多关节型幼年特发性关节炎。未来,修美乐®(阿达木单抗注射液)预计将会继续拓展新的适应症。修美乐®治疗非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎的适应症已被纳入我国第二批临床急需境外新药名单。
3.正大天晴布地奈德混悬液或已获批。正大天晴的4类仿制药吸入用布地奈德混悬液的上市申请已发布批件,经过两轮资料发补,该品种将大概率获批。布地奈德混悬液属吸入性糖皮质激素,通过雾化器给药,原研是阿斯利康的普米克令舒,于2000年8月获FDA批准上市,并于2001年11月获批进口中国,规格为 0.5mg/2ml、1mg/2ml。目前国内暂无布地奈德混悬液仿制药获批上市,获批布地奈德气雾剂的国内企业为鲁南贝特和上海信谊。本次正大天晴获批后将拿下布地奈德混悬液的首仿,与原研药瓜分国内60亿市场。
4.百济神州瑞复美新适应症上市申请获受理。百济神州宣布,瑞复美(来那度胺,lenalidomide)联合利妥昔单抗治疗复发或难治性惰性淋巴瘤(滤泡型淋巴瘤或边缘区淋巴瘤)患者的进口药品新适应症上市申请已获国家药监局受理。这一适应症今年5月刚获FDA批准上市。瑞复美是百时美施贵宝旗下新基开发的一种口服免疫调节药物,主要用于治疗多发性骨髓瘤、骨髓增生异常综合征和淋巴瘤等血液癌症。百济神州拥有该药在中国的独家经销权。自2013年首次在中国获批上市以来,瑞复美已在中国获批两项针对成年多发性骨髓瘤患者的适应症。
5.基石药业合作产品ivosidenib获突破性疗法认定。Agios公司开发的异柠檬酸脱氢酶-1(IDH1)抑制剂TIBSOVO (ivosidenib)获FDA授予的突破性疗法认定,用于治疗IDH1突变的复发或难治性骨髓增生异常综合征(r/r MDS)。Ivosidenib此前已获FDA批准,用于治疗IDH1突变的复发或难治性急性骨髓性白血病(R/R AML)的成人患者。基石药业拥有ivosidenib 在大中华区的开发和商业化权益。一项Ⅰ期临床TIBSOVO单药治疗IDH1突变的r/r MDS患者显示出良好的耐受性,并可获得持久的缓解和持久的输血不依赖。500mg TIBSOVO组患者中位治疗时间为11.4个月时,总缓解率为75%,其中完全缓解(CR)率为42%。中位完全缓解持续时间尚未达到。
国际药讯
1.西安杨森抗抑郁新药Spravato获欧盟批准。强生旗下杨森宣布,欧盟委员会已批准Spravato(esketamine)鼻腔喷雾剂,联合一种选择性5-羟色胺再摄取抑制剂(SSRI)或5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRI),用于难治性重度抑郁症(TRD)成人患者的治疗。一项包含5个III期研究的临床项目数据表明,与抗抑郁药+安慰剂相比,Spravato与抗抑郁药联用能更大程度地减少抑郁症状,且最快在第2天起效。接受Spravato治疗的患者约有70%的症状减少≥50%。此外,约有一半的患者在4周的短期研究结束后达到缓解。
2.BMS递交CAR-T疗法监管申请。百时美施贵宝向FDA递交了靶向CD19抗原的CAR-T疗法lisocabtagene maraleucel(liso-cel)的生物制品许可申请,治疗复发/难治性大B细胞淋巴瘤(LBCL)成人患者,包括弥漫性大B细胞淋巴瘤患者(DLBCL)。Liso-cel此前已获FDA授予的突破性疗法认定和再生医学先进疗法认定。一项临床试验TRANSCEND NHL 001数据显示,在可评估的患者中,liso-cel的总缓解率达到73%,其中53%的患者达到完全缓解;临床中,产生的3级以上细胞因子释放综合征只在2%的患者中出现,只有10%的患者出现3级以上严重神经毒性。
3.口服糖尿病疗法关键性Ⅲ期试验数据积极。Poxel SA与住友制药联合开发的全球首款glimin类药物imeglimin,在治疗2型糖尿病的Ⅲ期临床TIMES 2中达主要终点。无论imeglimin作为单药疗法,还是与其它降糖疗法联合,都能使患者的糖化血红蛋白(HbA1c)水平得到显著降低。其中,imeglimin联合DPP-4抑制剂治疗可将患者的HbA1c水平较基线时降低0.92%,是多种联合疗法中表现最为优异的疗法。迄今为止,imeglimin已在三项关键性Ⅲ期试验中达到主要终点,Poxel SA公司计划明年向日本的监管机构递交imeglimin的上市申请。
4.第四代EGFR酪氨酸激酶抑制剂递交IND申请。Bridge公司已向FDA和韩国药监部门递交IND申请,申请启动其肺癌靶向疗法BBT-176的Ⅰ/Ⅱ期临床。BBT-176是一款创新EGFR酪氨酸激酶抑制剂,旨在抑制携带C797S突变的EGFR。在携带包括C797S在内的三重突变(Del19/T790M/C797S,和L858R/T790M /C797S)的异种移植动物模型中,BBT-176表现出强力的抗癌活性。而且,BBT-176与抗EGFR抗体联用,表现出显著增强的活性。该公司计划明年在韩国的晚期NSCLC患者中启动剂量递增研究,然后在韩国和美国进行进一步临床研究。
5.Catalyst公司与渤健合作开发补体抑制剂。Catalyst公司与渤健将联合开发潜在“best-in-class”C3补体抑制剂CB 2782-PEG,治疗患有地图样萎缩(GA)的干性年龄相关性黄斑变性(AMD)患者。临床前数据表明,单次注射125μg的CB 2782-PEG,经28天后,可使非人灵长类动物的C3(补体级联反应的中央调节因子)清除率超过99%。根据协议,Catalyst将负责CB 2782-PEG的临床前开发,而渤健将为其提供相应开发资金;Catalyst将获得1500万美元的预付款、3.4亿美元的潜在里程碑付款以及产品销售额分成;渤健将获得CB 2782-PEG和其它抗C3蛋白酶的开发和全球独家推广权益。
6.罗氏与Rheos Medicines合作开发免疫代谢新疗法。罗氏与Rheos Medicines签署了一笔近8亿美元的合作协议,合作开发用于自身免疫和炎性疾病的新药物。Rheos成立于2018年,致力于通过调整免疫细胞中的代谢途径来开发免疫介导疾病的治疗方法,同时通过鉴定新的靶点和生物标志物,保证药物的精确性。根据协议,Rheos将负责开发具新靶标的免疫代谢疗法;罗氏将支付4250万美元的现金预付款,9000万美元的特定研究和临床前里程碑以及期权费;罗氏将拥有研究成果的独家许可权;Rheos还将有资格获得额外的最高约6.6亿美元的特定开发、监管和销售相关里程碑付款以及销售分成。
医药热点
1.大麻药品纳入英国国民医疗体系。英国国家医疗服务体系(NHS)21日正式宣布,将在三周内,为癫痫患者开具含有大麻成分的药物处方。NHS将从明年1月6日起,与制造商达成协议将大麻素药物大麻二醇(Epidiolex)纳入NHS。已有临床试验表明,大麻二醇与另一种药物氯巴扎姆(Clobazam)联合使用,可使某些儿童的癫痫发作次数减少40%。
2.抗肿瘤药临床应用有新规。国家卫健委发布《新型抗肿瘤药物临床应用指导原则(2019年版)》明确,抗肿瘤药物临床应用是否合理,基于以下两方面:有无抗肿瘤药物应用指征;选用的品种及给药方案是否适宜。同时,在临床应用中,应充分考虑抗肿瘤药物的效价比,优先选择有药物经济学评价和效价比高的药品。据悉,此次涉及的新型抗肿瘤药物是指小分子靶向药物和大分子单克隆抗体类药物。
3.北京流向基层医疗机构费用4年连增。北京市2018年卫生总费用核算结果发布。结果显示,2018年,北京市社会卫生支出1529.96亿元,比上年增长13.53%;社会办医支出和社会医疗保障支出有较明显的增长,增速分别达20.01%和16.6%;2018年北京市人均卫生总费用为11609.06元,比上年增加13.14%;流向基层医疗卫生机构费用增长增速为21.02%,其占机构费用总量的比重已连续4年增长,2018年达9.82%。
股市资讯
【舒泰神】(1)公司及子公司三诺佳邑公示治疗乙型肝炎病毒感染相关疾病的基因药物“STSG-0002注射液”的药物I期临床试验信息.(2)公示关于凝血因子X激活剂“注射用STSP-0601”的药物I期临床试验信息。
【兴齐眼药】股东桐实投资于2018年11月29日至2019年12月20日期间累计减持366.36万股,累计股份变动比例为5%。
【益盛药业】公司及下属子公司累计收到政府补助1541.29万元,其中与收益相关的有1261.29万元,占公司归属于上市公司股东净利润的18.26%;与资产相关的有280万元。
审评动向
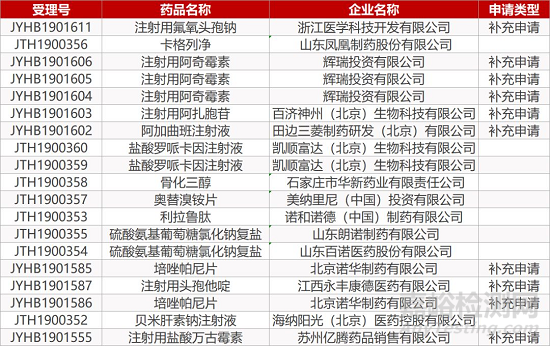
1. CDE最新受理情况(12月23日)
2. FDA最新获批情况(北美12月22日)
暂无

来源:药研发


