您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-28 15:58
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
信迪利单抗一线治疗非鳞状NSCLC即将获批。信达生物信迪利单抗第2项适应症上市申请审评状态已处于“在审批”阶段,有望于近期获批,用于联合培美曲塞+铂类一线治疗非鳞状非小细胞肺癌(NSCLC)。信迪利单抗注射液是信达生物和礼来合作开发的一款PD-1抑制剂,此前已获NMPA批准用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。值得一提的是,今年1月13日,信达已经提交了该新药第5项适应症上市申请。
国内药讯
1.复星mRNA新冠疫苗香港获紧急使用授权。复星医药与BioNTec公司联合开发的新冠mRNA疫苗COMIRNATY(BNT162b2,復必泰)获香港药监部门紧急使用授权。一项全球Ⅲ期临床结果显示:BNT162b2达到了所有主要疗效终点,在预防新冠病毒感染方面的有效性为95%,针对65岁以上成年人的有效性超过94%,在各个年龄、性别、种族和族群人口上呈现一致的有效性。这款同类型的mRNA疫苗目前已获英国、美国、加拿大、欧盟等逾50个国家和地区的卫生监管部门的授权使用。
2.安斯泰来「吉瑞替尼」即将在华获批上市。安斯泰来富马酸吉瑞替尼片(gilteritinib)上市申请审评状态已处于“在审批”阶段,有望近期获批,用于治疗FLT3突变阳性(FLT3mut+)复发或难治性急性髓系白血病(AML)成人患者。吉瑞替尼是安斯泰来与Kotobuki制药合作开发的一款FLT3抑制剂,已先后在日本和美国获批上述适应症,是FDA批准的首个用于复发、难治性急性粒细胞白血病的FLT3抑制剂。
3.基石RET抑制剂pralsetinib公布临床最新进展。基石药业将在WCLC 2020会议上以口头报告形式介绍其与Blueprint Medicines的合作品种普拉替尼(pralsetinib)用于RET融合阳性非小细胞肺癌(NSCLC)治疗的中国患者亚组研究数据。截止2020年5月22日的数据显示,pralsetinib在可评估患者中的客观缓解率为56.3%;患者的临床获益率为81.3%,疾病控制率为96.9%,达到临床疗效的中位时间为1.9个月;中位缓解持续时间(DOR)尚未达到,6个月的DOR率为83.1%。
4.中药1类新药健腰密骨片获批临床。上海和黄药业与上海中医药大学附属龙华医院合作开发的中药1类新药健腰密骨片获国家药监局临床试验默示许可,拟开发用于治疗肾虚血瘀型老年性骨质疏松症之腰痛。骨质疏松症是一种系统性、全身性的骨骼疾病,也是老年常见病,其临床症状多为骨骼疼痛和骨折。目前,市场上尚无明确治疗老年骨质疏松性腰痛的药物。
国际药讯
1.礼来新冠中和抗体组合疗法达Ⅲ期主要终点。礼来(Eli Lilly)制药新冠中和抗体组合疗法(bamlanivimab(LY-CoV555)和etesevimab(LY-CoV016))Ⅲ期临床BLAZE-1结果积极。与安慰剂相比,这一组合联合标准护理将患者与COVID-19相关的住院和死亡风险降低70%(p=0.0004);该研究同时还达到包括降低病毒载荷等多个次要终点。目前该公司已向FDA递交了紧急使用授权申请,用于治疗高风险的轻中度COVID-19患者。值得一提的是,LY-CoV016是由君实生物与中科院微生物所共同开发,去年礼来从君实生物获得授权,主导大中华地区以外全球地区的临床开发。
2.再生元新冠抗体组合疗法Ⅲ期结果积极。再生元(Regeneron)新冠中和抗体组合疗法REGEN-COV(casirivimab和imdevimab)在预防COVID-19的Ⅲ期临床中获积极中期结果。这项试验在那些因为家中有COVID-19患者而感染风险升高的人群中评估REGEN-COV用于预防COVID-19的效果。结果显示,与安慰剂相比,REGEN-COV在预防出现症状的COVID-19方面达到100%的效力。两组参与者患上COVID-19的比例分别为0(0/186)和3.58%(8/223),如果算上无症状感染者,REGEN-COV将总感染风险降低50%。
3.Agios创新别构激活剂mitapivat达Ⅲ期临床终点。Agios Pharmaceuticals “first-in-class”口服丙酮酸激酶受体PKR别构激活剂mitapivat,在治疗需要定期输血的丙酮酸激酶(PK)缺乏症成人患者的Ⅲ期临床ACTIVATE-T中达到主要临床终点。患者在接受固定剂量mitapivat治疗24周期后,与患者历史输血负荷相比,37%(n=10)患者的输血负荷降低≥33%(单侧p=0.0002)。此外,22%(n=6)患者无需再输血。该公司计划在今年第二季度向FDA递交新药申请(NDA)。
4.阿斯利康BTK抑制剂头对头III期临床结果积极。阿斯利康(AstraZeneca)BTK抑制剂阿卡替尼(acalabrutinib)对比伊布替尼治疗既往接受过治疗的慢性淋巴细胞白血病(CLL)成年患者的III期临床ELEVATE-RR(ACE-CL-006)获积极结果。根据独立审查委员会评估的分析结果,与伊布替尼治疗组相比,acalabrutinib治疗组患者在PFS上显示出统计学意义的显著改善;该治疗组患者的房颤发生率同样具统计学意义的显著降低。
5.子宫内膜异位症新药获Ⅲ期临床长期数据。辉瑞/Myovant口服GnRH受体拮抗剂relugolix治疗子宫内膜异位症的III期SPIRIT试验扩展研究获长期疗效结果。在52周期间,每日一次relugolix、雌二醇和醋酸炔诺酮的联合疗法,使患者的经痛和非经期盆腔痛得到临床意义的症状减轻。研究数据与SPIRIT 1和SPIRIT 2 III期研究的有效性和安全性数据相符,预计两家公司将于今年上半年提交联合疗法的监管申请。
6.Vir乙肝中和抗体早期临床结果积极。Vir Biotechnology乙肝抗体疗法VIR-3434在Ⅰ期临床中获积极结果。8名受试者分别接受VIR-3434或安慰剂治疗,初步数据显示,在单次注射的8天后,VIR-3434(6 mg)治疗组(6人)受试者的血清乙肝病毒表面抗原平均减少1.3 log10 IU/mL。目前该研究还在进行当中,之后产生的概念验证性数据将于医学会议上公布。该公司还计划今年下半年开展VIR-3434与VIR-2218(乙肝RNAi疗法)联合用药的Ⅱ期临床试验。
医药热点
1.全球新冠确诊病例破亿。北京时间2021年1月27日凌晨,根据约翰斯·霍普金斯大学的实时数据,全球新冠肺炎累计确诊病例突破1亿,死亡人数超过215万。这意味着全球75亿人,每70-80人中就有至少一个感染过新冠肺炎。截至目前,全球每周新增确诊病例仍维持在400万-500万人的高位。美国、印度、巴西、俄罗斯、英国、法国、西班牙、意大利、土耳其、德国是确诊人数排名前十的国家。
2.世卫不建议接种莫德纳疫苗。世卫组织专家组对莫德纳新冠疫苗mRNA-1273的数据进行评估后,26日发布了该疫苗的暂行使用建议。世卫组织将于2月底就是否将该疫苗纳入紧急使用清单作出决定。美国疾控中心22日发布的一份报告显示,截至1月10日,全美共有4041396人接种了第一剂莫德纳公司研发的新冠疫苗,共报告了1266起不良反应事件,其中包括10起过敏反应。
3.湖北规范互联网医院药学服务。湖北省卫健委印发《湖北省互联网医院药学服务管理办法》。《办法》规定,互联网医院不得对疫苗、血液制品、麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品,以及其他用药风险较高或有特殊管理规定的药品处方进行审核、配送及流转,相关药品不得纳入互联网医院药品目录。在处方调配方面,互联网医院开具并审核合格的处方可在互联网医院实体医疗机构调配取药、委托第三方药品配送企业配送或流转至零售药店取药。
4.吉林省提高疫情较重地区一线医务人员补助标准。吉林省长春、通化、松原地区疫情防控形势当前较为严峻,按照吉林省政府统一部署,该省财政厅25日出台政策,加大财政投入力度,支持各地做好疫情防控工作。其中,对派往疫情较重的通化市等地参与一线疫情防控的医务人员,根据具体分工情况,在国家补助标准每人每天300元或200元的基础上再提高一倍,达到每人每天600元或400元,所需资金由省级财政全额承担。
股市资讯
【灵康药业】(1)全资子公司 “灵康制药”收到国家药监局核准签发的注射用兰索拉唑《药品注册批件》,该药品用于口服疗法不适用的伴有出血的十二指肠溃疡。(2)2020年10月26日至2021年1月27日,王文南合计减持公司股份75.64万股,占公司总股本的0.11%。
【百奥泰】贝伐珠单抗注射液(BAT1706)在美国FDA上市许可申请获得受理。
【复星医药】控股子公司复星医药产业收到国家药监局关于同意注射用FN-1501对晚期恶性实体瘤患者进行剂量探索Ⅰ期临床研究及对晚期肝细胞癌患者进行Ⅱ期临床研究的批准。
审评动向
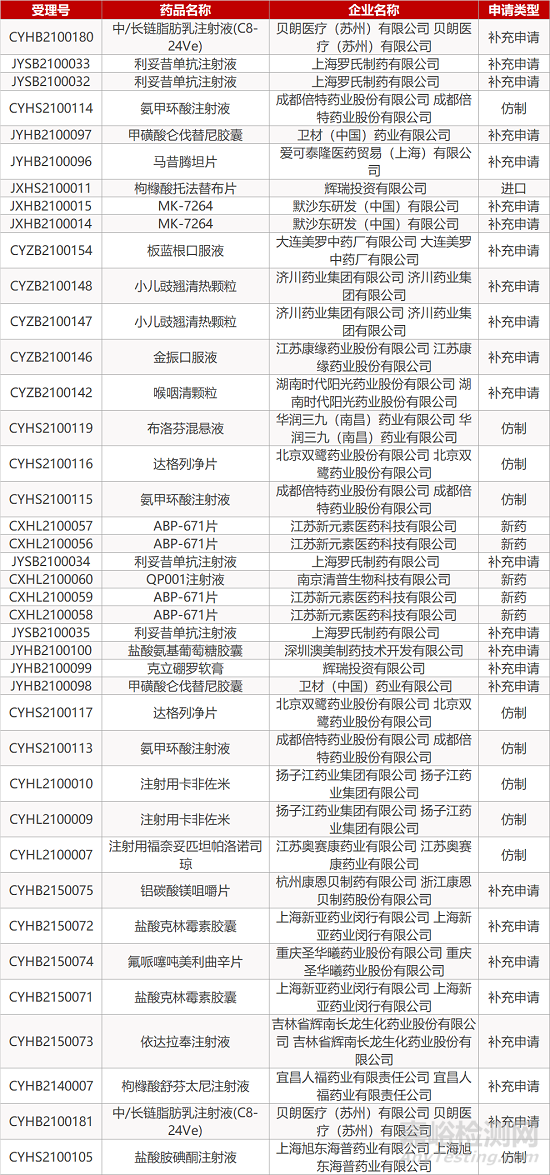
- The End -

来源:药研发