您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-05 09:17
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
拜耳MRA受体拮抗剂申报中国上市。拜耳MRA受体拮抗剂Finerenone上市申请获CDE受理。Finerenone是一种潜在“first-in-class” MRA受体拮抗剂,拟开发用于治疗患有2型糖尿病(T2D)的慢性肾病(CKD)患者。在一项III期研究FIDELIO-DKD(NCT02540993)中,与安慰剂相比,finerenone可显著降低糖尿病肾病患者因肾原因死亡的复合事件发生率,且安全性耐受性良好。今年1月,FDA已授予Finerenone用于治疗T2D CKD患者的优先审评资格。
国内药讯
1.齐鲁两款注射剂首家通过一致性评价。齐鲁制药盐酸伊立替康注射液、盐酸昂丹司琼注射液以补充申请形式获批通过一致性评价,均为这两个品种首家通过一致性评价的仿制药。盐酸伊立替康注射液2019年在中国公立医疗机构终端抗肿瘤药注射产品中排在第二十位,销售额超过7亿元,其中原研厂家辉瑞和齐鲁分别约占35%和40%的市场份额。盐酸昂丹司琼注射液2019年在中国公立医疗机构终端止吐药和止恶心药注射产品中排名第五,销售额超过6亿元,齐鲁合计市场份额超过七成。
2.科兴新冠灭活疫苗申报中国上市。科兴中维新冠病毒灭活疫苗克尔来福®附条件上市申请获国家药监局受理。该疫苗在境外Ⅲ期临床中已获得积极结果,克尔来福®接种后安全性良好,完成两剂接种14天后,针对由新冠病毒感染引起的疾病(COVID-19)的保护效力方面已达到世卫组织及国家药监局要求的相关技术标准。目前已在巴西等多国获紧急使用授权。
3.两种国产新冠疫苗对南非突变毒株依然有效。中国疾控中心高福等在bioRxiv发布正在开展Ⅲ期临床的重组蛋白亚单位新冠疫苗ZF2001(由智飞生物与中科院微生所高福院士团队联合开发)和已获批上市的新冠灭活疫苗BBIBP-CorV(北京生物制品研究所等联合开发)对南非新变种的保护效果。结果显示,虽然这两种疫苗接种者血清对南非新变种的中和效果稍有下降,但是依然保留大部分中和活性,提示这两种疫苗对南非新变种依然有保护效果。
4.诺诚健华泛FGFR抑制剂美国临床进展。诺诚健华1类创新药ICP-192用于治疗FGFR基因异常的晚期胆管癌及尿路上皮癌患者的国际II期试验在美国完成首例受试者给药。ICP-192是诺诚健华旗下具有全球自主知识产权的小分子泛FGFR抑制剂,拟开发用于多种实体瘤的治疗。目前该新药正在中美同步进行临床开发,已有近20例患者入组该项国际研究,并已在FGFR阳性患者中观察到部分缓解和完全缓解病例。
5.东阳光药鲁拉西酮迟释片申报临床。东阳光药2.1类新药鲁拉西酮迟释片临床试验申请获CDE受理。鲁拉西酮(Latud)是由住友制药开发的一款非典型(第二代)抗精神病药物,为多巴胺D2、5-HT2A及5-HT7受体拮抗剂。原研药盐酸鲁拉西酮片2019年1月已获批进口中国,用于成人精神分裂症的治疗,目前国内市场上暂无该品种其他剂型的产品获批进口或仿制。
国际药讯
1.阿斯利康新冠疫苗AZD1222公布最新结果。阿斯利康/牛津大学新冠疫苗AZD1222在《柳叶刀》上公布Ⅲ期临床最新结果。基于17177名受试者中积累的332例出现症状的COVID-19患者数据显示,接种一剂疫苗能够产生76%的保护效力,而且两次接种间隔在12周以上,疫苗的保护效力达到82%。在防护重症COVID-19方面,接种两剂疫苗的效力达到100%。此前,英国监管机构已授予该疫苗紧急使用授权,并建议两次疫苗接种的间隔时间为4-12周。
2.默克MET抑制剂获FDA加速批准上市。FDA加速批准默克旗下EMD Serono口服MET抑制剂Tepmetko(tepotinib)上市,用于治疗携带MET外显子14(METex14)跳跃变异的转移性非小细胞肺癌(NSCLC)成人患者。在一项关键性Ⅱ期临床VISION中, Tepmetko在初治和经治患者中均达到43%的总缓解率;两组中位缓解持续时间分别为10.8个月(95% CI,6.9-NE)和11.1个月(95% CI,9.5-18.5),两组缓解持续时间6个月以上的患者比例分别为67%和75%,缓解持续时间9个月以上的患者比例分别为30%和50%。
3.慢病毒基因疗法MB-107早期临床结果积极。Mustang Bio慢病毒基因疗法MB-107在用于治疗X连锁重症联合免疫缺陷病(XSCID)新诊断患者的Ⅰ/Ⅱ期临床中获积极结果。16例患者随访时间范围为3个月至47个月时,显示该疗法在所有患者中耐受性良好,可观察到稳定的载体标记,并成功将修饰基因转导入相关淋巴细胞中。在中位随访2年时,未发现恶变证据。
4.葛兰素史克联合CureVac开发下一代mRNA新冠疫苗。葛兰素史克与CureVac公司将开展一项新的1.5亿欧元合作,采用多价和单价疫苗策略,共同开发下一代mRNA新冠疫苗,旨在为各种不同的新冠病毒突变体提供更广泛的保护。此次合作将建立在CureVac第一代新冠候选疫苗CVnCoV的基础上,CVnCoV目前正处于Ⅱb /Ⅲ期临床开发阶段。葛兰素史克还将在2021年支持生产高达1亿剂的CureVac。
5.渤健放弃帕金森氏症药物cinpanemab临床开发。渤健(Biogen)宣布已终止帕金森病候选药物cinpanemab(BIIB054)的临床开发。Cinpanemab是Neurimmune公司开发的一款抗α-突触核蛋白(syn)单抗,在治疗帕金森病患者的概念验证Ⅱ期临床SPARK中未达到主要和次要终点指标,与安慰剂相比未能显著改善帕金森病患者的MDS-UPDRS评分。渤健表示今后将重点转向其阿尔茨海默病药物aducanumab的开发。
医药热点
1.第四批集采中标结果公布。上海阳光采购网2月3日公布了《全国药品集中采购拟中选结果公示》。第四批集采共有215个品种进行报价,158个中选,中选率为历次国采最高(73.5%);158个拟中选品种价格的平均降幅为52%,最高降幅达96%;此次共有152家企业参与投标,118家中选,成功率也是历次国采最高(77.6%)。其中,齐鲁、扬子江、石药、中国生物和复星均有6个品种中标。
2.安徽建立老人就诊绿色通道。安徽省卫健委发文明确要求各级各类医疗机构要立即建立方便老年患者挂号就诊的绿色通道。在新冠疫情低风险地区的二级及以上医疗机构,在老年患者就医时一般不查验健康码;对因疫情防控工作确需查验健康码的,医疗机构要设立老年患者通行通道,配备足够数量工作人员帮助代查代办,或通过人工填写等方式登记调查,确保老年患者顺利就医。
3.电子病历系统评价及专家管理办法出台。国家卫健委发布《国家卫生健康委医院管理研究所关于印发电子病历系统应用水平分级评价工作规程和专家管理办法的通知》。《通知》指出,国家卫健委负责管理全国分级评价工作,具体工作由国家卫健委医院管理研究所承担。各省级卫健行政部门负责本辖区内分级评价工作。医院研究所将开发“电子病历分级评价平台”并向省级单位和医疗机构开放相应权限。
股市资讯
【恒瑞医药】SHR0302片(JAK1抑制剂)治疗溃疡性结肠炎的全球多中心II期临床达到主要终点。
【华海药业】伏立康唑片拟中标第四批全国集采,约定采购金额7742.32万元,2020年公司该品种销售额6214.33万元。
【海思科】3个产品,盐酸普拉克索缓释片(0.375mg)、培哚普利叔丁胺片(4mg)、恩曲他滨替诺福韦片(200mg)拟中标第四批全国集采。
审评动向
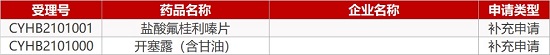
1. CDE最新受理情况(02月04日)
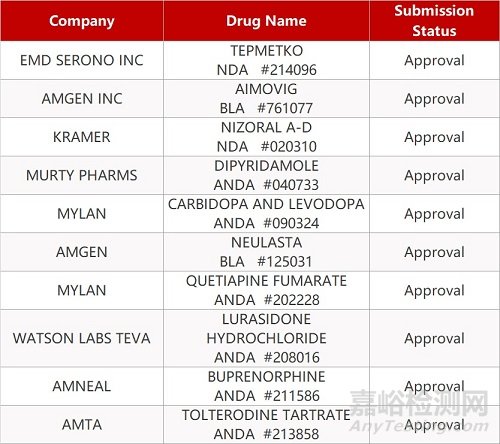
2. FDA最新获批情况(北美02月03日)

来源:药研发


