您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-27 09:52
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
普克鲁胺治疗新冠在美进入III期临床。开拓药业在美国开展的普克鲁胺治疗轻中症新冠男性患者的III期临床完成首例受试者入组及给药。该项研究是一项随机、双盲、安慰剂对照、全球多中心的关键性临床试验,旨在评估普克鲁胺在这类患者中的有效性和安全性。主要终点是28天内患者住院(包括死亡)的百分比,次要终点包括28天内死亡率,以及第7天、第14天和第28天临床评估等。
国内药讯
1.罗氏阿替利珠单抗新适应症即将获批。罗氏(Roche)旗下基因泰克PD-L1单抗阿替利珠单抗(atezolizumab)新适应症上市申请审评状态变更为「在审批」,预计即将获批上市,用于单药一线治疗PD-L1阳性、EGFR/ALK阴性的转移性非小细胞肺癌患者。这是Atezolizumab在国内获批的第3项适应症。该新药此前已获批的2项适应症分别为:联合化疗用于一线治疗广泛期的小细胞肺癌;联合贝伐珠单抗一线治疗晚期不可切除的肝细胞癌。
2.君境生物两款抗肿瘤新药获批临床。君境生物两款1类新药获国家药监局临床许可,分别为拟用于治疗晚期非小细胞肺癌的EGFR-exon20抑制剂AP-L1898胶囊、以及拟用于治疗晚期恶性实体瘤的XPO1抑制剂WJ01024片。君境生物是由君实生物与微境生物共同投资成立。2020年9月,君实生物与微境生物达成在全球范围内共同开发、生产及商业化微境生物的4款抗肿瘤药物的研发合作,AP-L1898和WJ01024是这项研发合作的两款在研药。
3.恒瑞两款新药获批临床。恒瑞两款新药SHR-1314注射液和硫酸氢伊伐布雷定缓释片获CDE临床试验默示许可。SHR-1314是一款IL-17A重组单抗,其用于治疗中重度慢性斑块型银屑病患者的临床开发已进入III期阶段。伊伐布雷定是一种单纯的降低心率药物,由施维雅原研。国内目前仅有原研产品盐酸伊伐布雷定片上市销售;国内外尚无硫酸氢伊伐布雷定缓释片获批上市销售。
4.君实免疫疗法BTLA单抗申报新临床。君实生物重组人源化抗BTLA单克隆抗体注射液(JS004)的临床试验申请获CDE受理。JS004是君实自主研发的全球首个进入临床开发阶段的特异性针对B和T淋巴细胞衰减因子(BTLA)的重组抗体药物,拟用于黑色素瘤、肺癌、淋巴瘤等实体瘤的治疗。该新药目前已在美国完成Ia期剂量爬坡阶段,进入Ib/II期剂量扩展阶段。在中国,在晚期实体瘤患者中开展的I期临床正在进行患者招募入组。
5.维立志博PD-1/TGFβRⅡ融合蛋白LBL-015国内申报临床。南京维立志博自主研发1类新药注射用LBL-015的临床试验申请获CDE受理。LBL-015是一种双功能融合蛋白,由高亲和力的PD-1单抗和TGFβRⅡ蛋白两部分融合而成,能够同时阻断PD-1/PD-L1和TGFβ免疫抑制通路,拟用于肺癌、消化道恶性肿瘤、肝癌、膀胱癌等多种实体肿瘤的治疗。注射用LBL-015已在美国获临床试验许可,此次为国内首次申报临床。
国际药讯
1.艾伯维BCL-2抑制剂联合低甲基化剂治疗AML欧盟即将获批。欧洲药管局人用医药产品委员会推荐批准艾伯维与罗氏开发的首创BCL-2抑制剂Venclyxto(venetoclax)上市,与低甲基化剂联用治疗新诊断的、没有资格接受强化化疗的急性髓性白血病(AML)成人患者。在一项Ⅲ期研究VIALE-A(M15-656)中,与阿扎胞苷+安慰剂相比,venetoclax+阿扎胞苷方案显著延长总生存期(OS)(中位OS:14.7个月vs9.6个月)、死亡风险降低了34%(HR=0.66;95%CI:0.52-0.85;p<0.001);并将复合完全缓解率提高一倍多(66.4%vs28.3%,p<0.001)。
2.罗氏IL-6R单抗Enspryng治疗NMOSD欧盟即将获批。欧洲药管局人用医药产品委员会(CHMP)推荐批准罗氏(Roche)IL-6R单抗Enspryng(satralizumab),作为单药疗法或联合免疫抑制疗法(IST),用于治疗抗水通道蛋白-4抗体(AQP4-IgG)阳性的视神经脊髓炎谱系障碍(NMOSD)青少年(年龄≥12岁)和成人患者。如果获批,Enspryng将成为欧盟首个治疗AQP4-IgG血清阳性NMOSD的皮下治疗方案,可以在家里每4周给药一次。在中国,Enspryng于去年7月被纳入优先审评审批程序。
3.吉利德JAK1抑制剂治疗UC申报新适应症。吉利德与卫材联合开发的口服选择性JAK1抑制剂Jyseleca(filgotinib)已在日本提交了新适应症上市申请,用于治疗中重度活动性溃疡性结肠炎(UC)患者。在一项Ⅱb/Ⅲ期SELECTION研究中,Jyseleca 200mg剂量组第10周达到临床缓解并且第58周维持临床缓解的患者比例均显著高于安慰剂组。目前,Jyseleca治疗UC新适应症也正在接受欧盟监管审查。
4.SINE抑制剂Selinexor治疗脂肪肉瘤疗效积极。Karyopharm公司塞利尼索(selinexor)治疗脂肪肉瘤的III期临床(SEAL)积极结果发表于Future Oncology上。与安慰剂相比,Selinexor显著延长无进展生存期(中位PFS:2.83个月vs 2.07个月;HR=0.70;p=0.023);同时改善了关键的生活质量(HRQoL)参数,疼痛的发生率和恶化的速率更低,至临床疼痛恶化的时间更长,至下次治疗的中位时间也更长。德琪医药拥有该新药在亚太地区的开发和推广权益。
5.基因疗法APB-102获FDA新药临床许可。Apic Bio公司基因疗法APB-102获FDA批准,即将在美国开展I/II期临床试验,评估鞘内给予APB-102对SOD1突变肌萎缩侧索硬化(ALS)患者的安全性、耐受性和有效性。APB-102由下一代重组腺相关病毒(AAV)衣壳和微核糖核酸(miRNA)载体组成,旨在减缓或逆转SOD1 ALS的进展。临床前概念性研究已经证明APB-102可抑制突变SOD1基因活性。
6.罗氏公布一季度业绩报告,同比增长3%。罗氏公布2021年第1季度业绩,总收入149.3 亿瑞士法郎,同比增长3%。诊断业务收入43.3亿瑞士法郎,同比增长55%,Q1中国区所有品种总收⼊增长11%。制药业务收入106亿瑞士法郎,下滑9%,其中Rituxan、 Avastin和Herceptin收入总计下降16亿美元,但是新产品(2012年之后上市)销售收入同比增长20%,为罗氏带来52亿美元收入,占制药业务50%。
医药热点
1.全球医药创新指数榜单出炉!礼来夺冠。英国医药咨询公司IDEA Pharma日前发布2021年医药创新指数和医药发明指数排行榜,百济神州首次上榜,分别位列第27位和第5位,是唯一上榜的中国制药企业。恒瑞医药继2020年上榜后,今年无缘榜单。全球医药创新指数排名前八分别为:礼来、罗氏、再生元、Seagen、Incyte、葛兰素史克、赛诺菲、阿斯利康。
2.美国新冠疫苗接种率下降。当地时间4月25日,美国《纽约时报》报道称全美新冠疫苗接种率正在下降。目前美国日均接种疫苗数量降至286万剂,为3月31日以来的最低水平。全美有超过500万人未接种第二剂疫苗,约占全部疫苗接种者的8%。根据采访显示,人们未接种第二剂疫苗的原因包括担心副作用、疫苗供应短缺以及错误地认为一剂疫苗可以提供充分保护。
3.8位华人学者当选美国艺术与科学院院士。当地时间4月22日,美国艺术与科学学院宣布252名新入选院士名单。其中有8位华人科学家当选,分别为普林斯顿大学结构生物学家颜宁、斯坦福大学计算机科学家李飞飞、斯坦福大学化学家鲍哲南、哈佛大学免疫学家吴皓、麻省理工学院神经科学家蔡理慧、中国科学技术大学地球科学家沈延安,耶鲁大学物理学家曹慧、斯坦福大学通讯专家孟怀萦。
审评动向
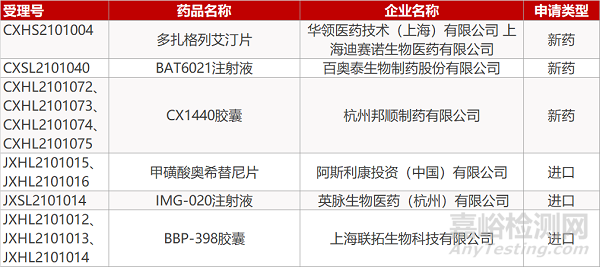
华领医药/迪赛诺生物的多扎格列艾汀片、百奥泰的BAT6021注射液、杭州邦顺的CX1440胶囊(4个规格)、阿斯利康的甲磺酸奥希替尼片(2个规格)、英脉生物的IMG-020注射液、联拓生物的BBP-398胶囊(3个规格)。
2. FDA新药获批情况(北美04月23日)
暂无

来源:药研发


