您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-15 21:13
摘 要: 建立高效液相色谱-串联三重四级杆质谱测定西格列汀中亚硝胺类杂质Nitroso-STG-19(NTTP)的方法。西格列汀样品用水溶解,以乙酸乙酯为提取溶剂进行超声提取,离心后取乙酸乙酯层,用Agilent Infinity Lab Poroshell 120 SB-AQ色谱柱(100 mm×3.0 mm,2.7 μm)分离,柱温为40 ℃,以水(含0.1%甲酸)和甲醇(含0.1%甲酸)为流动相,梯度洗脱,流量为0.6 mL/min。采用大气压化学电离源、正离子扫描、反应监测模式进行检测。NTTP的质量浓度在0.2~3.0 ng/mL范围内与色谱峰面积线性关系良好,相关系数为0.998,检出限为0.750 ng/g,定量限为1.500 ng/g。测定结果的相对标准偏差为2.7%(n=6),样品加标平均回收率为101.0%。该方法可为控制西格列汀中NTTP的含量提供方法支持。
关键词: Nitroso-STG-19; 高效液相色谱-串联三重四极杆质谱; 西格列汀
2022年8月9日,美国食品药品监督管理局(FDA)官网发文称,在一种用于治疗Ⅱ型糖尿病(T2DM)的处方药西格列汀中发现了亚硝胺类杂质Nitroso-STG-19,化学名为7-亚硝基-3-(三氟甲基)-5,6,7,8-四氢-[1,2,4]三唑并[4,3-a]吡嗪,简称NTTP[1]。为避免药物短缺并确保患者获得充足的药物供应,FDA不会禁用西格列汀,但需要控制用量。NTTP属于亚硝胺类化合物,是公认的具有较高致癌性的化合物,目前虽然还没有可靠的数据来直接评估NTTP致癌的可能性,但FDA用与其密切相关的亚硝胺化合物的信息来计算NTTP终生暴露限度。FDA指出,NTTP的临时可接受摄入量为每天246.7 ng,终生暴露水平为每天37 ng。临时可接受摄入量引发的癌症风险水平大于终生暴露水平,因此NTTP的可接受摄入量应为每天37 ng。
西格列汀是全球第一个上市的口服降糖药,属于二肽基肽酶-4 (DPP-4)抑制剂,由美国默沙东研制和销售,该药是Ⅱ型糖尿病患者必需的独家重磅产品[2‒3]。西格列汀于2006年10月获得美国FDA批准,可单药或与二甲双胍、噻唑烷二酮类药物联合使用,用于改善Ⅱ型糖尿病的血糖控制[4‒6]。2007年4月,西格列汀与二甲双胍的复方制剂在美国获批上市[3]。西格列汀市场份额大[7‒10],而西格列汀中NTTP含量控制成为药物质量控制的重要任务。
亚硝胺杂质在极低暴露量的情形下具有高度致癌性,常规的色谱分析方法难以达到灵敏度要求[11],而更高灵敏度的质谱仪器广泛用于亚硝胺杂质的研究中,以保证亚硝胺类杂质能够准确有效地检出[12‒15]。袁松等[16]采用电喷雾离子源(ESI),建立了超高效液相色谱-串联质谱(UPLC-MS/MS)法测定磷酸西格列汀中基因毒性杂质NTTP,该方法回收率偏高,且需要控制进样盘温度,方法较为繁琐。笔者利用大气压化学离子源(APCI),建立高效液相色谱-串联三重四极杆质谱法测定西格列汀中NTTP。该方法对目标化合物分离效果良好,专属性强,灵敏度高,可为西格列汀中NTTP的检测提供参考。
1、 实验部分
1.1 主要仪器与试剂
液相色谱-质谱联用仪:TSQ-Quantis型,美国赛默飞世尔科技公司。
电子天平:(1)QUINTIX125D-1CN/SQP型,感量为0.01 mg;(2)BSA224S-CW型,感量为0.1 mg;德国赛多利斯公司。
超纯水机:FDY8002-UV-E型,青岛富勒姆科技有限公司。
旋涡混合器:QT-2A型,上海琪特分析仪器有限公司。
乙酸乙酯、甲酸、甲醇:均为色谱纯,上海星可高纯溶剂有限公司。
NTTP对照品:纯度(质量分数)为98.3%,批号为22359174 s-WJ-01,斯坦德科创医药科技(青岛)有限公司。
西格列汀片样品:50 mg/片,批号为STD-005-001,某企业提供。
实验用水为超纯水,由青岛富勒姆超纯水机制得,临用新制。
1.2 仪器工作条件
1.2.1 色谱条件
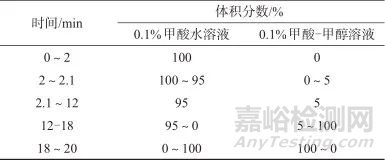
色谱柱:Agilent Infinity Lab Poroshell 120 SB-AQ柱(100 mm×3.0 mm,2.7 μm,美国安捷伦科技有限公司);流动相:A相为0.1% (体积分数)甲酸水溶液,B相为0.1% (体积分数)甲酸-甲醇溶液,流量为0.6 mL/min;柱温:40 ℃;进样体积:20 μL;洗脱方式:梯度洗脱,洗脱程序见表1。
表1 梯度洗脱程序
Tab. 1 Gradient elution procedures
1.2.2 质谱条件
离子源:大气压化学离子源(APCI);电离方式:正离子;汽化器温度260 ℃;离子转移管温度:260 ℃;检测方式:反应监测(SRM)模式;母离子:m/z 222.125;子离子:m/z 192.00 (定量离子)、165.113、177.024;去簇电压:85 V;碰撞能量:19.49、21.26、10.22 eV。
1.3 溶液配制
空白基质溶液:称取5 g西格列汀片空白辅料于锥形瓶中,准确加入50 mL水,涡旋60 s,准确加入50 mL乙酸乙酯,涡旋30 s,超声10 min,以12 000 r/min转速离心5 min,取乙酸乙酯层即得。
NTTP对照品储备液:600 ng/mL,精密称取NTTP对照品适量,用水溶解、稀释并定容。
NTTP对照品中间溶液:15 ng/mL,精密量取NTTP对照品储备液适量,用水逐步稀释并定容。
NTTP对照品校准溶液:1.5 ng/mL,精密量取NTTP对照品中间溶液适量,置于离心管中,准确加入2 mL水,涡旋60 s,再加入2 mL空白基质溶液,涡旋30 s,超声10 min,以12 000 r/min转速离心5 min,取空白基质溶液层,即得。
NTTP系列校准溶液:精密量取NTTP对照品中间溶液20、60、200、300、400 μL,按照NTTP对照品校准溶液配制方法,配制成质量浓度分别为0.2、0.4、1.5、2.2、3.0 ng/mL的NTTP系列校准溶液。
样品溶液:将固体西格列汀片研碎,精密称取0.2 g样品,置于10 mL离心管中,准确加入2 mL水,涡旋60 s,准确加入2 mL乙酸乙酯,涡旋30 s,超声10 min,以12 000 r/min转速离心5 min,取乙酸乙酯层,即为样品溶液。
1.4 实验方法
取NTTP对照品校准溶液和样品溶液,按照1.2仪器工作条件进样分析,记录色谱峰面积,按照色谱峰面积外标法计算样品中的NTTP含量。
2、 结果与讨论
2.1 色谱条件优化
2.1.1 色谱柱温度
称取样品适量,精密称定,加入NTTP对照品中间溶液200 μL,按样品溶液配制方法制备加标样品溶液。调整色谱柱温度分别为35、40、45 ℃,其他仪器条件按1.2设定,每种温度下各平行测定2次,计算测定结果的相对标准偏差(RSD),结果见表2。由表2可知,色谱柱温度在35~45 ℃范围内,测定结果的相对标准偏差为2.5%,表明在该温度范围内色谱柱温度对测定结果的影响较小,灵敏度可达到检测要求。考虑到仪器自身的波动性,选择色谱柱温度为40 ℃。
表2 不同色谱柱温度时的测定结果
Tab. 2 Determination results at different column temperatures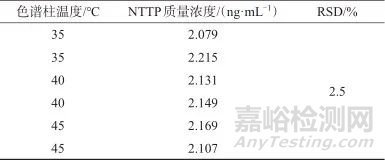
2.1.2 柱流量
称取样品适量,精密称定,加入NTTP对照品中间溶液200 μL,按样品溶液配制方法制备加标样品溶液。调整色谱柱流量分别为0.54、0.60、0.66 mL/min,其他仪器条件按1.2设定,每种流量下各平行测定2次,计算测定结果的相对标准偏差,结果见表3。由表3可知,色谱柱流量在0.54~0.66 mL/min范围内,测定结果的相对标准偏差为3.8%,表明在该流量范围内流量对测定结果影响较小,灵敏度可达到检测要求。考虑到仪器自身的波动性,选择柱流量为0.60 mL/min。
表3 不同柱流量时的测定结果
Tab. 3 Determination results at different column flow rates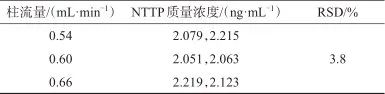
2.2 方法专属性
取空白基质溶液、样品溶液、对照品溶液,按所建方法分别进行测定,记录色谱图(如图1所示)。由图1可以看出,在优化的仪器工作条件下,NTTP在4.867 min出峰,空白基质溶液、样品溶液对目标峰无干扰,该方法专属性良好。
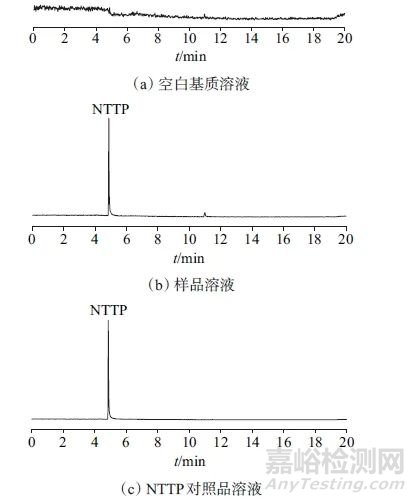
图1 空白基质溶液、样品溶液和NTTP对照品溶液总离子流图
Fig.1 Total ion chromatograms of blank matrix solution,simple solution,NTTP reference solution
2.3 线性方程和检出限、定量限
在1.2仪器工作条件下,测定NTTP系列校准溶液,以目标物的质量浓度为横坐标(x),以对应的色谱峰面积为纵坐标(y),绘制校准曲线。计算得线性方程为y=1 548.454 2x-86.605 1,相关系数为0.998。表明NTTP质量浓度在0.2~3.0 ng/mL范围内与色谱峰面积线性关系良好。
将NTTP对照品校准溶液逐级稀释,在1.2仪器工作条件下测定,分别以3倍和10倍信噪比对应的质量浓度作为方法检出限和定量限,根据称样质量和定容体积换算成样品中的含量,以质量分数(ng/g)表示。计算得方法检出限为0.750 ng/g,定量限为1.500 ng/g。
2.4 精密度试验
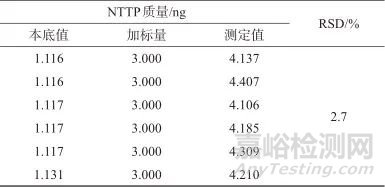
取同一批样品,平行称样6份,每份称取约0.2 g,分别加入NTTP对照品中间溶液200 μL,按样品溶液配制方法制备加标样品溶液,在1.2仪器工作条件下进行分析,结果见表4。由表4可知,6份加标样品溶液测定结果的相对标准偏差为2.7%,表明该方法精密度良好。
表4 精密度试验结果
Tab. 4 Results of precision test
2.5 样品加标回收试验
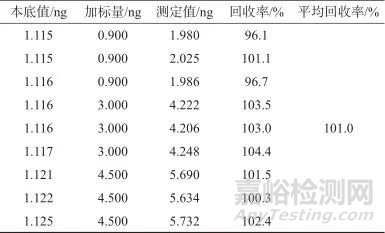
取同一批样品,平行称样3份,每份称取约0.2 g,分别加入NTTP对照品中间溶液60、200、300 μL,进行低、中、高3种浓度水平的加标回收试验,每种加标水平取样3次进行分析,结果见表5。由表5可知,样品加标平均回收率为101.0%,表明该方法准确度良好,满足痕量物质的检测要求。
表5 样品加标回收试验结果
Tab. 5 Results of spiked recycling test
2.6 溶液稳定性试验
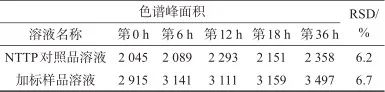
取NTTP对照品溶液和加标样品溶液,分别于配制完成后第0、6、12、18、36 h取样测定,计算色谱峰面积,结果见表6。由表6可知,NTTP色谱峰面积测定结果的相对标准偏差分别为6.2%、6.7%,表明NTTP对照品溶液和加标样品溶液在36 h内稳定性均良好。
表6 溶液稳定性试验结果
Tab. 6 Results of solution stability test
3、 结语
建立了测定西格列汀中基因毒性杂质NTTP的高效液相色谱-串联三重四极杆质谱法。用乙酸乙酯溶剂处理样品,毒性较小,大幅度降低了对人员和环境的影响。该方法操作简单,具有良好的线性、准确度和精密度,可为控制西格列汀中NTTP的含量提供方法参考。
参考文献:
1 FDA works to avoid shortage of sitagliptin following detection of nitrosamine impurity[EB/OL].(2022-08-09)[2024-01-06]. https://www.fda.gov/drugs/drug-safety-and-availability/fda-works-avoid-shortage-sitagliptin-following-detection-nitrosamine-impurity.
2 祝成楼,吴琼,达明绪.西格列汀治疗2型糖尿病的胰腺癌风险评估:来自随机对照试验的荟萃分析结果[J].临床荟萃,2023,38(12):1 061.
ZHU Chenglou,WU Qiong,DA Mingxu. Risk assessment of pancreatic cancer in patients with type 2 diabetes mellitus treated with sitagliptin:A meta-analysis of randomized controlled trials[J]. Clinical Focus,2023,38(12):1 061.
3 张明,张荣迪,刘璐,等.西格列汀二甲双胍复合制剂治疗2型糖尿病的药物经济学评价[J].实用药物与临床,2023,26(12):1 104.
ZHANG Ming,ZHANG Rongdi,LIU Lu,et al. Pharmacoeconomic evaluation of fixed-dose combination of sigliptin and metformin in the treatment of type 2 diabetes mellitus[J]. Practical Pharmacy & Clinical Remedies,2023,26(12):1 104.
4 王雪,孙冠男,田会景,等.二肽基肽酶4抑制剂对2型糖尿病疗效的网状Meta分析[J].中国药物评价,2021,38(3):235.
WANG Xue,SUN Guannan,TIAN Huijing,et al. Efficacy of dipeptidyl peptidase 4 inhibitors in the treatment of type 2 diabetes mellitus:a network meta-analysis[J]. Chinese Journal of Drug Evaluation,2021,38(3):235.
5 李居一,张媛媛,倪英群,等.西格列汀二甲双胍治疗2型糖尿病患者的效果及对氧化应激的影响[J].中国临床保健杂志,2020,23(3):361.
LI Juyi,ZHANG Yuanyuan,NI Yingqun,et al. The therapeutic effect of sitagliptin metformin compound on patients with type 2 diabetes mellitus and the effect of oxidative stress[J]. Chinese Journal of Clinical Healthcare,2020,23(3):361.
6 杨燕,王珍,王德峰.新型降糖药物贝格列净的临床研究进展[J].实用医学杂质,2023,39(22):3 015.
YANG Yan,WANG Zhen,WANG Defeng. Clinical research progress of bexagliflozin:a new hypoglycemic drug[J]. Journal of Practical Medicine,2023,39(22):3 015.
7 李子艳,王春丽,黄瑶庆,等.全球糖尿病药物市场概览[J].药学进展,2021,45(10):793.
LI Ziyan,WANG Chunli,HUANG Yaoqing,et al. Report on global sales of antidiabetic drugs[J]. Progress in Pharmceutical Sciences,2021,45(10):793.
8 刘永贵,田红,解学星,等.治疗2型糖尿病的非胰岛素类药物的研究进展[J].现代药物与临床,2013,28(2):108.
LIU Yonggui,TIAN Hong,XIE Xuexing,et al. Research progress in non-insulin drugs used for treating type 2 diabetes[J]. Drugs & Clinic,2013,28(2):108.
9 祝菁菁,陈文.西格列汀治疗2型糖尿病的药物经济学研究[J].中国药房,2016,27(2):157.
ZHU Jingjing,CHEN Wen. Pharmacoeconomic evaluation of Sitagliptin in the treatment of type 2 diabetes mellitus[J]. China Pharmacy,2016,27(2):157.
10 李子艳,王春丽,高柳滨.全球糖尿病治疗药物研发及市场态势[J].药学进展,2018,42(9):710.
LI Ziyan,WANG Chunli,GAO Liubin. Global report on R & D and marketing trend of anti-diabetic drugs[J]. Progress in Pharmceutical Sciences,2018,42(9):710.
11 葛雨琦,叶晓霞,乐健,等. N-亚硝胺类基因毒性杂质毒性与检测方法研究进展.药物分析杂志. 2020,40(1):83.
GE Yuqi,YE Xiaoxia,LE Jian,et al. A Review of research progress on N-nitrosamine genotoxic impurities[J]. Journal of Pharmaceutical Analysis. 2020;40(1):83.
12 张帆,吕明,佟飞,等.化学药物中亚硝胺杂质的控制策略及审评考虑[J].中国药事,2023(12):1 431.
ZHANG Fan,LYU Ming,TONG Fei,et al. Considerations and Requirements for control of nitrosamine impurities in chemical drugs[J]. Chinese Pharmaceutical Affairs,2023(12):1 431.
13 赵舒婧,瞿敏敏,王朝霞,等.药物基因毒性杂质及其检测方法研究现状[J].中国药理学与毒理学杂志,2023,37(3):229.
ZHAO Shujing,ZHAI Minmin,WANG Zhaoxia,et al. Research progress in genotoxic impurities of drugs and detection methods[J]. Chinese Journal of Pharmacology and Toxicology,2023,37(3):229.
14 詹健,朱登文,张甲利,等. N-亚硝胺类化合物检测研究进展[J].分析化学进展,2023(13):513.
ZHAN Jian,ZHU Dengwen,ZHANG Jiali,et al. Research progress on the detection of N-nitrosamines compounds[J]. Advances in Analytical Chemistry,2023(13):513.
15 胡克荣,陈瑞,班玉娟,等.基因毒性杂质的控制策略及其在HPLC-MS 中的应用[J].药物化学,2022,10(3):247.
HU Kerong,CHEN Rui,BAN Yujuan,et al. Control strategies for genotoxic impurities and their application in HPLC-MS[J]. Hans Journal of Medicinal Chemistry,2022,10(3):247.
16 袁松,李婕,张娜,等. UPLC-MS/MS法测定磷酸西格列汀中基因毒性杂质NTTP[J].药学研究,2023,42(12):1 000.
YUAN Song,LI Jie,ZHANG Na,et al. Determination of genotoxic impurity NTTP in Sitagliptin Phosphate by UPLC-MS/MS[J]. Journal of Pharmaceutical Reserach,2023,42(12):1 000.
引用本文: 刘雪,刘春霞,冯今奋,等 . 高效液相色谱-串联三重四极杆质谱法测定西格列汀中Nitroso-STG-19[J]. 化学分析计量,2024,33(9):69. (LIU Xue, LIU Chunxia, FENG Jinfen, et al. Determination of Nitroso-STG-19 in Sitagliptin by high performance liquid chromatography-tandem triple quadrupole mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(9): 69.)

来源:化学分析计量


