您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-17 09:41
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
信达双重激动剂品种上II期临床。信达生物与礼来联合开发的GLP-1R/GCGR双激动剂IBI362在超重/肥胖受试者中用于减重的II期临床研究(NCT04904913)完成首例受试者给药。IBI362是中国首个进入临床阶段的GLP-1R/GCGR双重激动剂周制剂。在早期临床试验中,该新药已显示出有效的控制血糖及减轻受试者体重方面的作用,体现了其在治疗糖尿病、肥胖及非酒精性脂肪性肝炎(NASH)方面的潜在疗效。
国内药讯
1.亦诺微溶瘤病毒上国际II期临床。亦诺微医药重组疱疹溶瘤病毒MVR-T3011在国际II期临床中分别完成了中国和美国的首例患者给药。MVR-T3011是一款全新的重组疱疹溶瘤病毒,具有国际领先的病毒骨架设计,在病毒骨架上引入PD-1抗体与IL-12外源基因,能够进一步地增强其抗肿瘤的效应。据悉,MVR-T3011已在早期临床中显示出较好的安全性与有效性;目前临床适应症包括黑色素瘤、非小细胞肺癌、乳腺癌等。
2.亚盛Bcl-2靶向新药在美获批临床。亚盛医药原创新药Bcl-2抑制剂APG-2575获FDA临床试验许可,将展开单药或与抗癌药物联合治疗晚期ER+乳腺癌或实体瘤的研究。该研究是一项全球多中心、开放性、Ib/II期临床,旨在评估APG-2575单药治疗晚期实体瘤患者,或联合CDK4/6抑制剂palbociclib治疗CDK4/6抑制剂治疗后进展或复发的ER+/HER2-转移性乳腺癌患者的安全性、耐受性、PK特征及初步疗效。
3.亚虹MetAP2抑制剂在美获批临床。亚虹医药MetAP2抑制剂APL-1202联合百济神州PD-1抑制剂替雷利珠单抗,用于肌层浸润性膀胱癌患者(MIBC)新辅助治疗的新药临床试验申请获FDA批准。这是一项国际Ⅰ/Ⅱ期临床,旨在评估联合用药治疗MIBC患者的安全性、作为MIBC新辅助治疗的Ⅱ期临床研究推荐剂量以及疗效等。在中国,APL-1202用于一线单药和二线联用化疗灌注治疗非肌层浸润性膀胱癌(NMIBC)患者的Ⅲ期临床正在进行当中。
4.先声药业CDK 4/6抑制剂获批临床。先声药业与G1 Therapeutics联合开发的注射用trilaciclib获国家药监局临床试验默示许可,拟开发用于治疗三阴性乳腺癌。trilaciclib是G1 Therapeutics开发的一款CDK 4/6抑制剂,已获FDA批准上市,用于降低广泛期小细胞肺癌患者在接受某些类型化疗时出现的骨髓抑制频率。该新药此前已在中国获批开展广泛期小细胞肺癌和转移性结直肠癌两项骨髓保护适应证的Ⅲ期临床。
5.劳拉替尼治疗NSCLS将启动国际临床。基石药业宣布与辉瑞在大中华地区共同开发第三代ALK抑制剂劳拉替尼(lorlatinib)用于治疗ROS1阳性晚期非小细胞肺癌(NSCLC)的国际关键性临床研究。在一项I/II期研究中,劳拉替尼在ROS1阳性晚期NSCLC 患者中的客观缓解率(ORR)与颅内ORR均有改善;针对脑转移阳性的患者,劳拉替尼也获得了较高的缓解率以及持久的缓解时间。在美国,lorlatinib已获FDA批准用于一线治疗ALK阳性转移性NSCLC患者。
国际药讯
1.两剂次新冠疫苗有效降低感染者住院风险。英国公共卫生部(PHE)发布一项评估一剂或两剂疫苗在预防Delta(印度最初发现,B.1.617)突变株的真实世界保护数据。基于今年4月12日到6月4日期间发现的14019例出现COVID-19症状的Delta变体感染病例,分析数据显示,针对Delta变体,接种一剂和两剂BNT162b2疫苗将住院风险分别降低了94%和96%;接种一剂和两剂ChAdOx1疫苗将住院风险分别降低了71%和92%。
2.“人造皮肤”治疗烧伤患者获FDA批准上市。FDA批准Mallinckrodt公司旗下Stratatech开发的皮肤组织StrataGraft上市,用于治疗仍保留部分深度皮肤组织的深度烧伤患者。StrataGraft由两层组成:底层植入人体纤维母细胞,顶层植入角质形成细胞。该组织用于缝合、固定并可保持创伤面的完整性,而且在伤口愈合过程中能够提供关键的屏障功能。此前它曾获FDA授予的再生医学先进疗法认定、优先审评资格和孤儿药资格。
3.新一代抗抑郁药达到Ⅲ期临床终点。Sage公司与渤健联合开发的新一代GABAA别构调节剂zuranolone(SAGE-217/BIIB125)在治疗重度抑郁症的Ⅲ期临床WATERFALL中达主要终点。与安慰剂相比,zuranolone治疗组患者15天时的17项汉密尔顿抑郁量表(HAMD-17)的评分降低1.7点(p=0.0141);而且在给药结束后4周时,该组患者HAMD-17的改善幅度仍然保留86.1%,不过与安慰剂组相比不具统计学意义。该新药的安全性特征与既往研究一致。
4.百时美施贵宝CAR-T疗法III期临床成功。百时美施贵宝公司(BMS)靶向CD19的CAR-T疗法Breyanzi(lisocabtagene maraleucel)用于复发/难治性大B细胞淋巴瘤(LBCL)二线治疗的III期临床TRANSFORM达到主要终点和关键次要终点。与当前标准护理方案 (包括高剂量化疗和造血干细胞移植)相比,Breyanzi使患者的无事件生存期(EFS)具统计学意义的显著改善;完全缓解率(CRR)和无进展生存期(PFS)也得到显著提高;总生存期(OS)数据尚未成熟。安全性结果与以往一致。
5.治疗CLL/SLL组合疗法Ⅲ期临床结果积极。强生Imbruvica联合罗氏旗下基因泰克公司的Venclexta(venetoclax)一线治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的III期临床GLOW研究获积极结果。中位随访时间为27.7个月时,这一口服组合疗法提供了优于输注方案chlorambucil+obinutuzumab 的无进展生存结果;在预定义的亚组(包括老年患者和较高共病评分的患者)中,无进展生存期的改善是一致的。详细数据在EHA2021会议上公布。
6.渤健基因疗法治疗眼疾Ⅲ期临床失败。渤健宣布其基因疗法timrepigene emparvovec在罕见遗传性眼病无脉络膜血症男性患者中的III期试验STAR未能达到主要和关键次要终点指标。单次视网膜下注射治疗12个月后,该疗法并未能提高患者最佳矫正视力较基线改善至少15个字母的患者比例;临床中,该新药的安全性结果与之前研究一致。STAR研究的完整数据集目前正在继续评估中。
医药热点
1.江苏完善合理用药考核机制。江苏省卫健委日前印发《江苏省医疗机构合理用药考核工作实施方案》,将对二级以上综合医院、专科医院和基层医疗机构(不含中医院)的药学技术人员配备、抗菌药物使用和管理、抗肿瘤药物使用和管理等指标进行考核。各医疗机构每3年为1个考核周期。
2.我国今年将再建成500家社区医院。国家卫健委联合国家中医药管理局日前印发《关于加快推进社区医院建设的通知》,计划于年底前再推进建成500家左右社区医院。《通知》要求,应以“一老一小”为重点完善社区医院功能布局,改善设施条件和设备配备,方便老年人和儿童看病就医,拓展妇幼保健和医养结合服务;应加强医防融合,提供慢性病防治和健康管理服务。
3.浙江将肿瘤PET-CT检查纳入大病保险支付范围。浙江省日前发布《关于将肿瘤全身断层显像纳入大病保险支付范围的通知》,从明确支付对象、支付范围、支付标准及支付监管四个方面对肿瘤PET-CT检查纳入大病保险做出明确规定。根据通知,浙江省将于6月30日起,在全国率先将肿瘤PET-CT检查纳入大病保险支付范围,并将6500元/次的价格调整为5300元/次。
审评动向
1. CDE新药受理情况(06月16日)

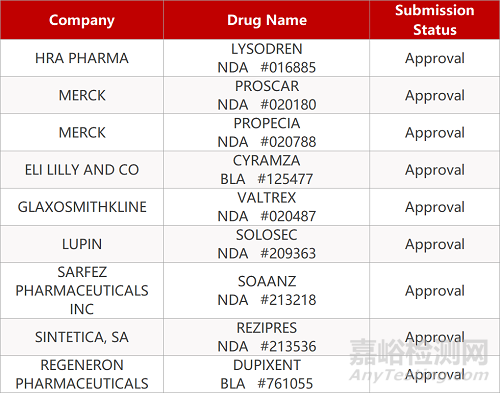
2. FDA新药获批情况(北美06月15日)

来源:药研发


