近日,国家药品监督管理局经审查,批准了美国Sequent Medical Inc.生产的创新产品“自膨式动脉瘤瘤内栓塞系统”注册。我们一起了解一下该产品在临床前研发阶段做了哪些实验。
一、产品概述
(一)产品结构及组成
自膨式动脉瘤瘤内栓塞系统由植入物和输送导丝组成。植入物为由镍钛合金丝、铂丝/镍钛合金复合丝编织而成的自膨式网状结构,两端含有铂铱合金不透射线标记,通过连接件和输送导丝连接。输送导丝由芯丝、导线、热缩管、聚酰亚胺管、线圈、加热丝、连接器、连接件等组成。产品经辐照灭菌,一次性使用。货架有效期4 年。
(二)产品适用范围
适用于在大脑中动脉分叉部,颈内动脉末端,前交通动脉复合体或基底动脉顶端使用,对动脉瘤直径为3mm 至10mm,且瘤颈尺寸≥4mm 或者瘤颈比>1 且<2 的囊状宽颈颅内分叉部动脉瘤成年患者进行血管内治疗。
(三)工作原理
产品采用微创介入方式治疗批准适用范围的颅内动脉瘤。
医生根据颅内动脉瘤的大小和形状选择合适规格和/或形状的自膨式动脉瘤瘤内栓塞系统(WEB)装置,WEB 装置通过可兼容的神经血管微导管(VIA 21, VIA27, VIA33)进入动脉瘤,然后通过专门设计的手持式电池供电的分离控制盒激发解脱(分离控制盒单独提供)。一旦释放到动脉瘤,WEB 装置植入物自动膨胀,以阻止血流进入动脉瘤口(瘤颈)并与动脉瘤壁贴合。
通过阻断动脉瘤内的血流,WEB 可促进装置内血栓的形成。由此充满血栓的装置产生机械阻塞,防止血液流入动脉瘤,从而使弱化的动脉瘤壁与血液循环系统隔离并降低破裂的风险。
二、临床前研究概述
(一)产品性能研究项目如下:
1、外观
2、尺寸
3、射线可探测性
4、植入物极限拉伸力
5、植入物圆顶释放力
6、植入物径向强度
7、植入物耐腐蚀性
8、反复释放疲劳
9、 解脱区域断裂力
10、解脱性能
11、解脱时间
12、输送导丝耐腐蚀性
13、输送导丝破裂试验
14、输送导丝弯曲试验
15、输送导丝拉伸力
16、推送和回撤性能
17、镍钛合金化学成分
18、镍钛合金显微组织
19、镍钛合金相变温度
20、还原物质
21、金属离子
22、酸碱度
23、紫外吸光度
24、蒸发残渣
25、无菌
26、热原
27、细菌内毒素
28、微粒控制
产品性能研究提交了产品技术要求中各项目指标及试验方法的确定依据及有关支持性资料,针对产品技术要求中相关物理机械性能指标进行了验证,并提供了MRI 兼容性、流场模拟研究(血流瘀滞模拟)等项目研究资料。该产品为无源医疗器械,产品在解脱过程中,需与9V 的分离控制盒配合使用,将释放在动脉瘤内的植入物与输送导丝分离。申请人提供了分离控制盒和该产品配合使用的电气安全测试报告和电磁兼容测试报告。
性能研究资料表明产品符合设计输入要求。
(二)生物相容性
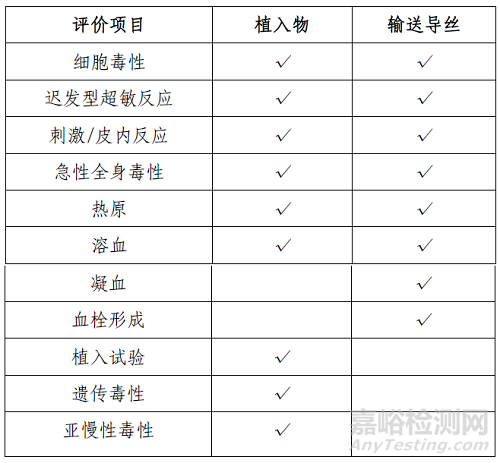
自膨式动脉瘤瘤内栓塞系统由植入物和输送导丝组成。植入物为持久血液接触,输送导丝为外部接入器械(循环血液,短期接触)。申请人依据GB/T 16886 系列标准,开展了生物相容性评价,提交了相关项目生物学试验报告。具体评价项目详见表3。
表3 生物相容性评价项目表
另外,还提交了产品可提取物和可沥滤物研究,镍离子溶出研究,神经毒性风险分析说明。产品生物学风险可接受。
(三)灭菌
该产品采用伽马射线辐照灭菌,无菌状态提供。申请人提供了灭菌过程确认报告,证明无菌保证水平可达10-6。
(四)产品有效期和包装
该产品货架有效期为四年。申请人提供了货架有效期验证报告,包括产品稳定性、包装完整性和运输模拟验证资料。
(五)动物研究
申请人开展了动物试验研究以验证产品使用可行性及安全性。试验采用新西兰白兔,经弹性蛋白酶诱导分叉动脉瘤建立病理模型。评价时间点包括植入后即时、1.5 个月、3 个月、12个月。评价指标包括有效性指标(包括动脉瘤栓塞的即时性,栓塞的程度,栓塞的持久性等)和安全性指标(包括栓塞系统的使用性能,可见性等)。实验结果表明产品可达到预期设计要求。