您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-09-10 15:11
2021年03月13日,CDE发布了《皮肤外用化学仿制药研究技术指导原则(试行)》,对比2018年07月11日发布的《新注册分类皮肤外用仿制药的技术评价要求(征求意见稿)》可以发现试行版删除了征求意见稿中的附件内容,即体外释放试验、体外透皮试验相关内容。只提出“体外释放试验建议参考国内外相关文献与指导原则(见参考文献 13、 15、 18、 21、 22、 23)开展相关研究工作。”
本文对体外释放试验相关参考文献中的内容进行整理如下。
一、体外释放试验方法
1. 试验次数

*初始方法验证或证明其等效性12个样品。常规释放至少6个样品
2. 试验时间

3. 试验条件
(说明:1. 阿昔洛韦个药指南体外释放试验环境控制:温度21℃±2℃相对湿度50%±20%RH;2. 主要适用于扩散池装置)
3.1 装置

*实验室需要鉴定安装膜的孔口的扩散面积、每个扩散池接收室的体积
3.2 人工膜

*加样前膜与受体介质原位平衡至少30分钟或与受体介质预孵育
**尽量减少接收介质的反向扩散,避免药品转化
3.3 制剂用量

3.4 交替给药

3.5 介质温度

3.6 释放介质

3.7 介质用量

*漏槽条件:药物接收介质中达到的最大浓度不超过其在接收介质中最大溶解度的30%。漏槽条件通常发生在至少是饱和体积3-10倍的介质中。
3.8 转速

3.9 取样点

*应在方法中指定时间±2分钟的容差范围内完成取样
3.10 补液

3.11 累积释放量

4. 释放试验方法验证

说明:EMA要求选择最有区分力的测试条件
*释放速率(斜率)与时间之间的线性关系
**制剂浓度与平均体外释放试验释放速率(斜率)之间的线性关系
***耐用性:如果所有体外释放试验的平均斜率(在改变的条件下)是在体外释放试验的精密度和重现性的平均斜率的±15%范围内,则可以认为该体外释放试验方法对试验方法的变化时耐受的。例如:
温度的变化(相对于32℃±1℃的+1℃和-1℃)
剂量体积变化(剂量体积的±10%)
接收液的变化(组成和/或pH值变化)
混合速率变化(搅拌速度的差异或不搅拌)
****处方浓度与药物释放速率的线性关系
*****项目同FDA,未提供具体参数
5. 数据分析

6. 资料撰写
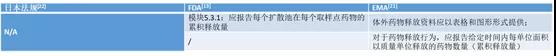
二、参考文献
说明:参考文献[22][13][15][21]编号按照文献[1]中参考文献编号整理
[1] CDE, 皮肤外用化学仿制药研究技术指导原则(试行)
[22]PMDA, 局所皮膚適用製剤(半固形製剤及び貼付剤)の処方変更のための生物学的同等性試験ガイドラインについて。2010 年 11 月
[13] USP42,General Chapters <1724>: Semisolid drug products-performance tests
[15] FDA,Draft Guidance on Acyclovir, December 2016
[21] EMA,CHMP: Draft guideline on quality and equivalence of topical products. December2018

来源:Internet


