您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-13 11:22
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
君圣泰HTD1801上降糖临床。君圣泰1类新药HTD1801完成2型糖尿病适应症中国PK桥接试验首批受试者入组及给药。HTD1801是君圣泰的核心产品,拟开发治疗代谢及消化系统疾病。此前,该药已获FDA授予的2项快速通道资格、1项孤儿药资格。已完成的临床研究显示,HTD1801可改善糖脂代谢、降低体重、降低肝脂、改善肝功,具有为2型糖尿病合并非酒精性脂肪肝患者带来治疗获益的潜力。
国内药讯
1.康泰生物13价PV获批上市。康泰生物旗下民海生物的13价肺炎球菌多糖结合疫苗(破伤风类毒素/白喉类毒素)获国家药监局批准上市。该疫苗采用双载体蛋白与肺炎球菌荚膜多糖结合技术,旨在减少疫苗载体诱导的表位抑制作用,提高其免疫原性。这款疫苗适用于2月龄-5周岁婴幼儿和儿童接种,预防由13种肺炎球菌血清型引起的侵袭性疾病,包括菌血症性肺炎、脑膜炎、败血症和菌血症。
2.普米斯生物两款双抗获批临床。普米斯生物两款新药(PM8001注射液和PM1003注射液)获国家药监局临床试验默示许可。PM8001是普米斯生物首个新药项目,是一款PD-L1/TGF-β双特异性抗体,该产品目前正在晚期实体肿瘤患者中开展Ⅰ期临床。此次PM8001获批的临床适应症为晚期肺癌。PM1003是一款PD-L1/4-1BB双抗,拟开发用于晚期恶性实体瘤。
3.罗氏PD-1/LAG-3双抗在华获批临床。罗氏1类新药RO7247669注射液获国家药监局临床试验默示许可。RO7247669是一款PD-1/LAG-3双特异性抗体,全球范围内正在开展多项Ⅰ/Ⅱ期临床试验。涉及的适应症包括转移性黑色素瘤、非小细胞肺癌、食管鳞状细胞癌、晚期肝癌等。本次为RO7247669首次在中国获批临床,拟开发用于肝癌的治疗。
4.君实Claudin18.2单抗报IND。君实生物Claudin18.2单抗JS012临床试验申请获CDE受理。JS012注射液通过靶向作用于Claudin18.2靶点,抑制相关信号通路,通过激活抗体依赖细胞介导的细胞毒性(ADCC)及补体依赖的细胞毒性(CDC)杀伤肿瘤细胞,拟用于治疗晚期恶性肿瘤,例如胃癌及胰腺癌等。全球范围内尚无同靶点药物获批上市;国内目前有19款靶向Claudin18.2的创新药在研,包括9款单抗、3款双抗、6 款ADC以及1款 CAR-T。
5.信达SIRPα抗体报IND。信达生物新型抗SIRP-alpha抗体IBI397(Alector 研发代号:AL008)的临床试验申请获CDE受理。AL008是 Alector公司开发的抗肿瘤新药,靶向SIRP-alpha/CD47信号通路,该信号通路被肿瘤广泛用于逃脱天然免疫系统的攻击。IBI397单药在临床前的人源化小鼠肿瘤模型中抑制了肿瘤生长,增强了M1型巨噬细胞活性。目前,这款产品在国内外均未启动临床。
国际药讯
1.辉瑞JAK抑制剂获英国NICE批准。英国国家卫生与临床优化研究所(NICE)发布最终指导草案,推荐辉瑞口服JAK抑制剂托法替尼(Xeljanz),用于治疗2岁及以上、已使用过抗风湿药物治疗反应不佳的活动性多关节型幼年关节炎和幼年银屑病关节炎患者。Xeljanz也是继优时比新型抗炎药IL-17A/17F双效抑制剂Bimzelx之后,第二种通过NICE新的快速低风险快速评估(Expedited Low-Risk Fast Track Appraisal)进行评估和推荐的药物。
2.恩格列净治疗心衰获FDA突破性疗法认定。FDA授予勃林格殷格翰与礼来联合开发的恩格列净(Jardiance)突破性疗法认定,用于治疗射血分数保留型心力衰竭(HFpEF)成人患者。在一项Ⅲ期临床EMPEROR-Preserved中,与安慰剂相比,恩格列净将这类患者的心血管死亡或因心力衰竭住院的相对风险降低21%。获益与射血分数或糖尿病状态无关。研究结果已于2021欧洲心脏病学会大会上公布。
3.MCT治疗糖尿病并发症Ⅲ期临床积极。Ixaka公司开发的富含单核细胞、粒细胞和CD34阳性细胞的人骨髓源性多细胞疗法(MCT)REX-001,在治疗慢性肢体威胁缺血(CLTI)的糖尿病患者的Ⅲ期临床获积极中期结果。与安慰剂组相比,EX-001治疗组12个月时达到溃疡完全愈合的患者比例更高,且无显著安全性问题。独立数据监查委员会(DMC)建议按计划继续试验。
4.C3补体抑制剂Ⅲ期临床结果发布。Apellis公司公布C3靶向疗法pegcetacoplan治疗年龄相关性黄斑变性(AMD)的地图样萎缩(GA)成人患者的两项Ⅲ期临床(DERBY和OAKS)顶线结果。汇总分析显示,在12个月时,与对照组相比,每月一次或每两个月一次给药pegcetacoplan治疗分别使GA病变生长减少17%(p<0.0001)和14%(p=0.0012);使中心凹外病变患者的GA病变生长分别降低26%(p<0.0001)和23%(p=0.0002)。该新药治疗GA的新药申请(NDA)预计明年上半年向FDA提交。
5.肿瘤电场疗法获突破性医疗器械认定。FDA授予Novocure公司肿瘤电场疗法NovoTTF-200T系统突破性医疗器械认定,与PD-L1抗体atezolizumab和VEGF抗体bevacizumab联用,一线治疗不可切除或转移性肝癌患者。在一项Ⅱ期临床HEPANOVA中,联合治疗在预后不良患者中的疾病控制率为76%,客观缓解率为9.5%;在完成至少12周肿瘤电场疗法治疗的患者中,疾病控制率为91%,客观缓解率为18%。
6.礼来联合ProQR开发RNA编辑疗法。礼来与ProQR Therapeutics达成一项全球合作和许可协议,将利用ProQR专有的Axiomer RNA编辑技术平台,共同开发和商业化多达五个RNA编辑靶标的创新疗法,以治疗肝脏和神经系统遗传疾病。根据协议,ProQR将获得2000万美元的预付款和3000万美元的股权投资,还有资格获得高达约12.5亿美元的开发、监管和商业化里程碑付款,以及产品的销售分成。
医药热点
1.胰岛素专项集采清单公布。9月10日,上海阳光药品采购网发布第六批国家组织药品集中采购(胰岛素专项)的二代及三代胰岛素相关企业及产品清单。此次集采涉及81个产品,涉及诺和诺德、礼来、赛诺菲、通化东宝、天麦生物、甘李药业、珠海联邦制药、誉衡药业、万邦生化和东阳光等10家企业。公示期为9月10日至13日,在公示结束后,将组织医药机构按清单填报需求量。
2.德国改用住院率为疫情监测指标。德国国会日前完成对传染病防治法的修订。德国今后动态调整防疫政策的主要参考指标将不再是“平均每十万人七日累计新增确诊病例数”,而将改为新冠住院率。德国联邦卫生部长施潘认为德国当前近62%的疫苗完全接种率仍然过低。德国医师协会主席莱因哈特呼吁政府重新设计推广疫苗接种的策略。
3.固定献血浆者年龄可延长至60周岁。国家卫健委发布《献血浆者须知(2021年版)》。2000年11月24日印发的《卫生部办公厅关于下发供血浆者须知的通知》同时废止。新版《须知》明确,既往无献浆不良反应、符合健康检查要求的固定献血浆者主动要求再次献血浆的,年龄可延长至60周岁。
4.世卫:呼吁全球公平分配新冠疫苗。当地时间8日,世卫组织举行新冠肺炎例行发布会,世卫组织总干事谭德塞表示,全球已接种55亿剂新冠疫苗,其中80%都在高收入和中等偏上收入国家。此前高收入国家曾承诺捐赠超过10亿剂疫苗,但只兑现了其中不到15%的剂量。谭德塞呼吁公平分配疫苗。
评审动态
申请临床:
扬州中宝的硫酸舒欣啶注射液、北京鑫康合生物的XKH001注射液、信达生物的IBI397、重庆宸安生物的门冬胰岛素注射液、北京双鹭的DT678片、迪哲(江苏)的AZD4205胶囊(2个规格)、派格生物的PB-201片(2个规格)、深圳华润九创/上海创诺的示踪用盐酸米托蒽醌注射液、浙江蓝盾药业的LD002注射液、再鼎医药的TPX-0022胶囊。
申请生产:
银杏树药业/以岭万洲的赛拉瑞韦钾片、施维雅的阿托伐他汀培哚普利氨氯地平片、安若维他药业/阿拉宾度制药的碳酸司维拉姆片。
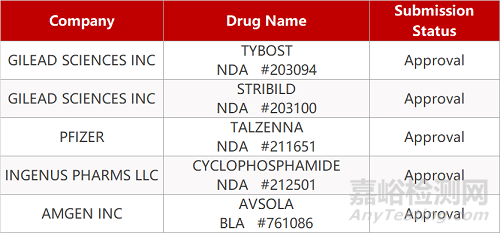
2. FDA新药获批情况(北美09月09日)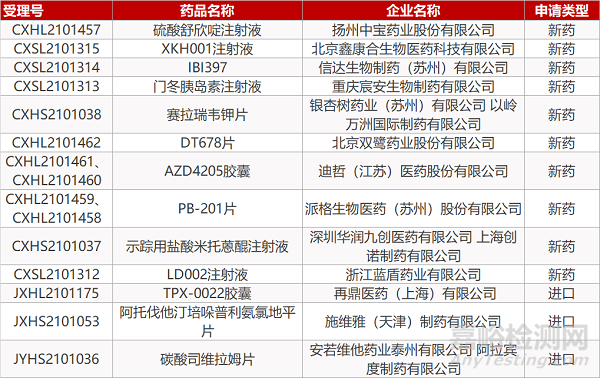

来源:药研发


