您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-08 10:40
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
国际药讯
1.molnupiravir抗新冠III期临床成功。默沙东抗新冠口服药物molnupiravir (MK-4482, EIDD-2801)III期临床MOVe-OUT研究获积极中期分析结果,将非住院的高风险轻症COVID-19患者的住院或死亡风险降低了50%(7.3%vs14.1%,p=0.0012)。该公司宣布将尽快向FDA提交紧急使用授权(EUA)申请,并在全球其他国家提交上市申请。目前默沙东已终止该项研究,并提前生产molnupiravir,预计2021年内能生产足够1000万疗程使用的药物。
2.吉利德CD19-CAR-T获批治疗ALL。FDA批准吉利德旗下Kite公司CD19靶向CAR-T疗法Tecartus( brexucabtagene autoleucel )扩展适应症,用于治疗复发或难治性B细胞急性淋巴细胞白血病(ALL)成人患者(18岁以上)。在一项临床试验中,Tecartus使65%的可评估患者(n=54)达到完全缓解(CR)或者完全缓解伴不完全血液学缓解(中位随访时间12.3个月)。超过半数获得CR的患者缓解持续时间超过12个月。Tecartus是首个获批治疗成人ALL的CAR-T疗法。
3.儿童肝脏疾病创新疗法获批上市。Mirum公司口服ASBT抑制剂Livmarli(maralixibat)获FDA批准上市,用于治疗1岁以上Alagille综合症(ALGS)儿童患者的胆汁淤积性瘙痒。ASBT介导小肠内胆汁酸的吸收,并帮助其循环回肝脏。Livmarli可使更多的胆汁酸随粪便排出,防止过量胆汁酸积累,控制与胆汁淤积性肝病相关的极度瘙痒。在一项关键性Ⅱb期临床中,Livmarli使这类患者瘙痒显著下降并且维持4年。
4.FIC干眼症疗法达Ⅲ期临床终点。Bausch + Lomb公司FIC眼药水疗法NOV03(全氟己基辛烷)在治疗与睑板腺功能障碍相关干眼症的第二项Ⅲ期临床达到所有主要和次要终点。与对照组相比,评估眼部损伤的总角膜荧光素染色(tCFS)指标在接受治疗第57天时出现统计显著改善(p<0.001);而且眼干评分的变化也具有统计显著改善(p<0.001)。该公司计划明年向FDA递交新药申请(NDA)。恒瑞医药拥有NOV03 的中国开发权益。
5.不限癌种TKI疗法获FDA突破性疗法认定。FDA授予Turning Point Therapeutics在研TKI疗法repotrectinib突破性疗法认定,用于治疗携带NTRK基因融合的晚期实体瘤。Repotrectinib是一种ROS1、TRK和ALK抑制剂,之前已被授予治疗ROS1阳性转移性非小细胞肺癌患者的突破性疗法认定。在临床试验中,repotrectinib在初治患者中达到86%的客观缓解率(ORR);在TKI经治且接受过化疗的患者中,ORR也达到40%。再鼎医药拥有repotrectinib在大中华区的开发及商业化权益。
6.阿斯利康/第一三共ADC获突破性疗法认定。FDA授予阿斯利康与第一三共联合开发的HER2-ADC新药Enhertu(trastuzumab deruxtecan)第四项突破性疗法认定,用于二线治疗不可切除/转移性HER2+乳腺癌。在一项Ⅲ期临床中,与对照组相比,Enhertu将这类患者的疾病进展或死亡风险降低72%(HR=0.28,95% CI,0.22-0.37);将PFS提高3倍(25.1个月vs7.2个月)。FDA此前已批准Enhertu上市,三线治疗经治HER2+无法切除或转移性HER2+乳腺癌,以及经trastuzumab治疗后进展的HER2+局部晚期或转移性胃癌和胃食管结合部(GEJ)腺癌患者。
7.OX40靶向特应性皮炎疗法Ⅱ期临床积极。日本协和麒麟与安进开发的潜在“first-in-class”抗OX40抗体KHK4083(AMG 451)在治疗中重度特应性皮炎的Ⅱ期临床达到主要终点。与安慰剂组相比,KHK4083治疗组16周后患者的EASI评分显著改善(EASI评分分别降低了57.4%,49.7%,61.1%和48.3%,vs15%)。所有治疗组也在关键性次要终点获得改善,包括达到EASI评分比基线降低至少75%的患者比例等。
医药热点
1.2021年诺贝尔生理学或医学奖揭晓。10月4日,瑞典卡罗琳医学院宣布将2021年的诺贝尔生理学或医学奖颁给来自美国加州大学旧金山分校的David Julius教授和霍华德·休斯医学研究所、斯克里普斯研究中心的Ardem Patapoutian教授,以奖励他们对感知温度与触觉受体的发现。David Julius利用辣椒素来识别皮肤神经末梢上对热做出反应的感觉受体(感受器)。Ardem Patapoutian利用压力敏感细胞发现了一种对皮肤和内部器官机械刺激作出反应的新型感受器。
2.上海“价高药”自负比例提高10%-20%。上海市日前发布《关于本市做好第五批国家组织药品集中采购和使用有关工作的通知》,为引导患者形成相应的用药习惯,将提高“价高药”使用的个人自负比例。上海市城保和居保参保人员使用“价高药”的,药品自负比例提高10%(基药和医保甲类)或20%(其他药品)。实行个人定额自负的抗癌药,参照上述药品适当上调定额自负标准。
3.日本发现新型蜱传病毒。日本北海道大学病毒学家松野及其研究团队9月份在《自然通讯》杂志上发表一篇最新研究论文。日本科学家发现了一种此前未知的新型病毒“Yezo病毒”,该病毒通过蜱虫叮咬传染给人类,可导致高达39度的高烧、血小板和白细胞数量的减少,严重时病患还会出现肝功能异常的迹象。截至目前,日本已有至少7人感染该病毒,尚无人员死亡。
评审动态
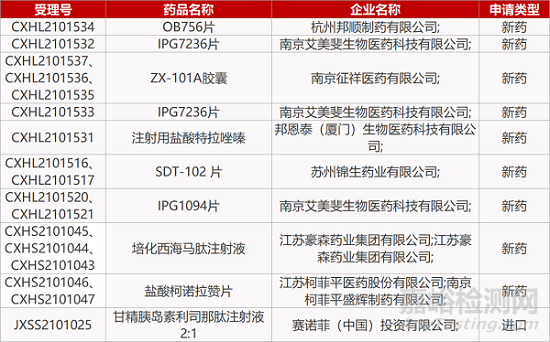
1. CDE新药受理情况(09月30日)

来源:药研发