您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-11 09:57
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
驯鹿双靶点CAR-T上注册临床。驯鹿医疗靶向CD19和CD22的自体T细胞注射液CT120在治疗复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)的I/II期注册临床中完成首例患者入组及单采。该公司同时宣布,CT120用于治疗复发/难治性急性B淋巴细胞白血病(B-ALL)的临床试验也即将开展。CT120是中国首个获批进入临床阶段的全人源双靶点CAR-T疗法,也是该公司的第2款CAR-T产品。
国内药讯
1.礼来“不限癌种”疗法在华报NDA。礼来RET抑制剂selpercatinib胶囊的上市申请获CDE受理。Selpercatinib(LOXO-292)是礼来收购Loxo Oncology获得的一款RET抑制剂,该药已于去年获FDA批准上市,是首个获批专门用于治疗携带RET基因变异癌症患者的精准疗法。在中国,selpercatinib已获批开展多项临床试验,包括在两项Ⅲ期临床中用于治疗晚期或转移性RET融合阳性NSCLC患者,和治疗RET突变型甲状腺髓样癌患者。
2.恩沃利单抗乙肝IIb期临床积极。歌礼制药皮下注射PD-L1抗体ASC22(恩沃利单抗)治疗慢性乙型肝炎患者的IIb期临床(NCT04465890)中期结果积极。接受1mg/kg ASC22治疗的33例患者中,16例在基线时乙肝表面抗原≤500 IU/mL,其中19%(3/16)的患者经ASC22治疗后实现乙肝表面抗原消失,且在ASC22停药后没有出现反弹,显示乙肝的功能性治愈。详细结果将在AASLD2021年会上公布。
3.康诺亚GPC3/CD3双抗报IND。康诺亚1类新药CM350的临床试验申请获CDE受理。这也是国内申报的首款GPC3/CD3双抗。在临床前研究中,CM350通过TDCC在从0.01nM开始的剂量水平下引起强效肿瘤细胞溶解,并在1nM下引起80%的溶解;与ERY974类似物(罗氏的一种GPC3/CD3双特异性抗体)相比,CM350在引起更强TDCC的同时,显示出最小的脱靶T细胞激活。
4.再鼎引进两款第四代EGFR抑制剂。再鼎医药与Blueprint Medicines就后者两款在研EGFR抑制剂(BLU-945和BLU-701)达成独家合作和许可协议,再鼎将获得这两款新药在大中华地区的开发和商业化权利。BLU-945和BLU-701均属于第四代EGFR非共价酪氨酸激酶抑制剂,用于治疗EGFR驱动的非小细胞肺癌(NSCLC)患者。根据协议,Blueprint将获得2500万美元的预付款,高达5.9亿美元的潜在里程碑付款,以及产品的销售分成。
5.基石药业与多特生物达成全球合作。基石药业与多特生物签订全球开发合作与期权协议,共同开发三款同类首创或同类最优下一代抗体疗法,包括多功能抗体药物和抗体偶联药物(ADC)。根据协议,基石将主导设计靶点组合,多特生物将主导分子设计和构建;基石药业有权获得候选药物的全球权益;多特生物将获得研究费用、股权投资和里程碑后付款,以及产品的销售分成。
国际药讯
1.可善挺®治疗幼年关节炎长期疗效积极。诺华抗炎药Cosentyx(可善挺®,secukinumab)治疗幼年特发性关节炎(JPsA或ERA)的Ⅲ期临床JUNIPERA数据积极。2年治疗数据显示,与安慰剂相比,Cosentyx显著延迟患者疾病发作时间,将疾病发作风险降低72%(p<0.001)。该儿科人群中的安全性与Cosenty已知的安全性特征一致。目前诺华已在欧洲和美国提交了Cosentyx治疗ERA和JPsA的上市申请。
2.Opdivo辅助治疗肺癌III期达主要终点。百时美施贵宝宣布 PD-1单抗Opdivo (纳武利尤单抗)联合化疗用于可切除的IB至IIIA期非转移性非小细胞肺癌(NSCLC)的III期CheckMate-816研究获积极结果。与术前单独化疗相比,Opdivo联合化疗组患者无事件生存(EFS)具有统计学意义的改善;而且辅助治疗的安全性与既往研究报道一致。今年4月,CheckMate-816已达到病理完全缓解(pCR)的另一个主要终点,详细数据已公布在2021 AACR大会上。
3.阿斯利康IL-5抑制剂获快速通道资格。FDA授予阿斯利康IL-5抑制剂Fasenra(贝那利珠单抗)快速通道资格,用于治疗伴随或不伴随嗜酸性粒细胞性胃肠炎(EGE)的嗜酸性粒细胞性胃炎(EG)。在美国、欧盟、日本和其他国家,Fasenra已获批作为重度嗜酸性哮喘的附加维持治疗药物,并在多个国家获批用于患者自我进行疾病管理用药物。
4.KRAS抑制剂组合初步临床积极。Mirati公司KRAS G12C抑制剂adagrasib联合PD-1抗体pembrolizumab一线治疗KRAS G12C突变非小细胞肺癌(NSCLC)的Ⅰb期临床结果积极。截至10月1日,7例可评估患者中有4例获得确认部分缓解;患者的疾病控制率(DCR)率为100%,肿瘤缩小幅度为37%~92%;中位随访时间为9.9个月时,其中5例仍然在接受治疗。今年6月,FDA已授予它突破性疗法认定。再鼎医药拥有adagrasib在大中华区的开发权益。
5.新型TCR细胞疗法早期临床积极。Immatics公司靶向PRAME的自体TCR细胞疗法IMA203在治疗实体瘤的Ⅰa期临床中获积极中期数据。试验结果显示,在滑膜肉瘤、恶性黑色素瘤、葡萄膜黑色素瘤和头颈癌患者中均观察到抗肿瘤活性;IMA203总体客观缓解率达到50%,有94%的患者实现疾病控制,88%的患者肿瘤缩小;IMA203安全性可控,未观察到高级别细胞因子释放综合征或神经毒性。
6.基因编辑公司Arbor完成新一轮融资。张锋博士联合创建的基因编辑公司Arbor宣布完成2.15亿美元的B轮融资。Arbor致力于发现新的基因编辑蛋白,开发为疾病“量身定制”的基因编辑疗法。目前该公司已发现了超过60种核酸酶家族和超过70种CRISPR转座酶(transposases)。此轮融资将支持Arbor用于肝脏和中枢神经系统(CNS)疾病的先导项目进入临床。
医药热点
1.国家癌症医学中心设置标准发布。国家卫健委发布《国家癌症医学中心设置标准》,明确国家癌症医学中心应当为三级甲等肿瘤专科医院或具备相应肿瘤专科能力的三级甲等综合医院。《设置标准》还对国家癌症医学中心应具备的医疗服务能力、教学能力、科学研究能力、承担公共卫生任务情况、落实医改相关任务情况、医院绩效等提出了具体要求。
2.黑河出台新冠病毒溯源奖励政策。黑龙江省黑河市11月8日发布《关于新冠病毒溯源工作的通告》。《通告》明确,对提供有价值线索帮助成功溯源的,奖励人民币10万元;对存在轻微违法行为主动说明情况的,免予处罚;对故意隐瞒、拒不提供真实情况影响溯源工作的,依据相关法律法规和防疫规定从严从重查处。
3.谷歌成立AI药物公司。谷歌母公司Alphabet在英国成立一家名为Isomorphic Labs的新药研发公司。该公司将借助谷歌旗下人工智能实验室DeepMind的研究进一步探索人工智能(AI)在药物发现方面的应用。Isomorphic Labs将专注于发展与制药公司的合作伙伴关系,为新药研发提高解决模型方案。DeepMind首席执行官Demis Hassabis将同时担任Isomorphic Labs的首席执行官。
评审动态
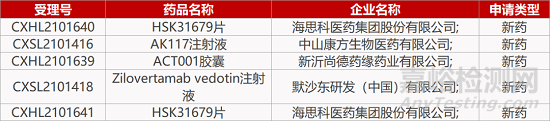
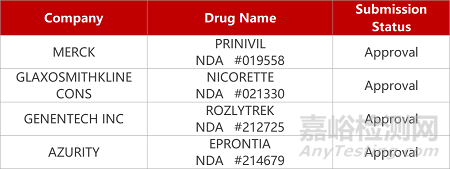

来源:药研发


