您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2025-02-06 16:43
随着监管体系的日益完善,制药行业,特别是注射剂生产工艺过程中,对于直接接触药物的过滤器,需要对过滤器与药物之间开展相关的工艺验证( 如细菌截留测试等) 。但由于某些验证研究测试的特殊要求,往往需要委托过滤器的供应商完成特定工艺条件下的过滤器工艺验证。进入到 A/B 级洁净区内的消毒剂,在适当条件下,为了获得无菌的消毒剂,同样需要除菌级过滤器进行过滤。对于过滤消毒剂的过滤器的验证尽管不需等同制剂的验证的严格度,但依然需要基于特定的使用情况,采用合适的方法,评估两者之间的适用性。
引言
在无菌制剂生产全流程中为了能够有效防控微生物的污染,关键的生产工艺环节应在受控环境中进行,受控区域内需要消毒剂的合理使用。根据各国 GMP 或相关法规的要求,可知对于洁净级别比较高的区域,如 A/B 级区所使用的消毒剂需要满足无菌的要求,有些企业基于 CCS 的评估确定,C 级和 D 级的消毒剂需要进行除菌过滤[1-3]。
从污染控制策略以及监管的角度出发,为了满足消毒剂无菌的要求,通常有两种方式:
方式一: 选择市售成品无菌消毒剂。该情况下,药企在对供应商资质进行适当确认的前提下,可以接受产品的分析报告或者合格证上的结果进行放行[2]。在日常管理中可以基于 CCS 评估结果,判定是否增加定期的无菌检测。
方式二: 选择非无菌消毒液或内部配制后,使用除菌级过滤器对其进行过滤除菌。如果使用过滤方法除菌,应评估消毒剂与所选择滤器材质之间的适用性。滤器使用后需进行完整性测试[4]。
通过具体案例需求、实际应用以及风险考虑等,针对上述方式,对如何“评估消毒剂与所选择滤器之间的适用性”展开思考。
为了更清晰描述,如下将以具体案例的形式展开,并不代表所有实际应用中的情况。背景: 某药企进入到 A/B 区需要使用无菌 75% 乙醇,决定将购买来非无菌高浓度乙醇,经过适当稀释后,并采用适当的过滤器过滤除菌的方式获取。
1、供应商的资质确认
对于无菌消毒剂的获取,不论是哪种方式,对于供应商资质的确认均是必要的,它是后续活动的前提条件。
过程中使用的过滤器以及非无菌高浓度乙醇等属于药企质量风险管理的物料管理模块,需对供应商进行全面的评估[5]。
2、过滤器的选型
应根据实际应用目的选择过滤器,该案例对于滤后溶液的无菌性有要求,则必须选择除菌级别过滤器,例如孔径为 0. 2μm 的除菌级过滤器。
值得一提的是,对于除菌级过滤器的确认,并非以孔径定义,而是使用细菌截留测试进行判定,用含有至少达到 1×107 cfu/cm2 过滤面积浓度的缺陷短波单胞菌的流体进行挑战时,依然可以产生无菌滤出液的过滤器[6-7]。
在过滤器的选型时应考虑消毒剂与滤器的兼容性,可以用供应商提供的滤器化学兼容性数据进行评估,选择过滤器文件中与消毒剂有相似理化性质的物质,如 pH 值、极性或离子强度等,从而评估消毒剂对该滤器无不良影响,选择出与所过滤该消毒剂的兼容的过滤器材质。
选择过滤器时还需要关注使用中的参数要求,例如过滤温度、最长过滤时间、灭菌条件等工艺参数,并确认这些参数是否在可承受范围内[4]。
需要综合多种因素,选择出适合的除菌级过滤器。
3、实际使用参数
为了更清晰描述,如下将以案例的形式提出明确的需求同时进行思考,并不代表所用实际应用中的情况,见表 1。
表 1
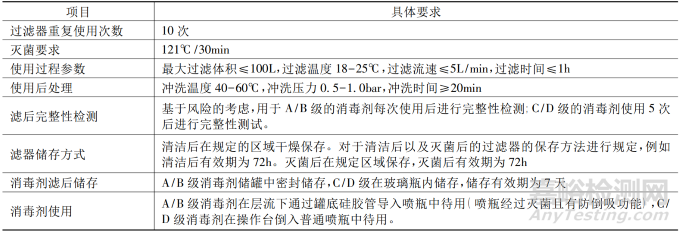
对于过滤器使用前及使用后的处理,应结合滤器供应商的建议及实际使用情况进行规定,在规定的冲洗温度、压力/流速、冲洗时间条件下进行处理、相关的清洁、储存方式以及过滤后消毒剂的生物负载结果等信息,均应该做记录体现。
如果滤器重复使用,后处理的方法要进行清洁验证。如果处理过程使用了碱液,在滤器验证过程中应进行考虑。
4、风险评估
证明消毒剂与所选过滤器之间适用,即证明两者之间是否会产生不良反应。例如对于过滤器而言,需要关注所过滤的消毒剂是否对于其产生结构性的影响甚至破坏,从而降低其过滤效果; 对于消毒剂而言,需要关注过滤后是否达到无菌性的预期效果。
风险评估应走在验证研究前面[8],因此,为了探究实际使用过程中的适用性,需要基于风险,具体识别关键影响因素。接下来对于过滤中可能的风险点进行展开。
4.1除菌效果评估
4. 1. 1 过滤器的角度
对于所使用过滤器的选择时,需要考虑其过滤效果,因此,需要选择除菌级过滤器。该型号的过滤器在产品上市之前均基于标准的法规要求,对其除菌效果进行了确认并形成了相关文件。
细菌截留测试属于破坏性测试,不能在生产过程中作为确认过滤器完好的方法。因此,过滤器制造商根据细菌挑战的结果给每种型号的过滤器特定的完整性限值标准。即将完整性值与细菌截留测试的结果进行了一定关联[9]。
因此,在前期供应商资质确认时,药企需要对于所购除菌级过滤器的文件进行确认。关注厂家提供的除菌级过滤器的细菌截留的能力、完整性测试的限值等相关文件。
4. 1. 2 配制用水的角度
从消毒剂配制用水的角度考虑,对于 A/B 级洁净区内消毒剂稀释配制的用水,对其有水质要求,应当符合注射用水的质量标准[1]。同时相应水点的管理也需要进行评估。
4. 1. 3 消毒剂的角度
消毒剂用于杀灭传播媒介上的微生物使其达到消毒或灭菌要求的制剂[10]。对于消毒剂而言,其生产商在产品上市前,基于合适验证方法,对其杀菌性进行测试研究,且对其真实性负责[11]。
对于药企还需结合特定环境状态( 如环境菌 种、使用载体) 、消毒剂的使用方式等进行消毒剂效力验证。
对于消毒剂使用效期的验证,除从消毒剂的效力角度,也包含对于其微生物污染状态的考察,进入 A/B 级的消毒剂需要保持在有效期内的无菌性。
4. 1. 4 环境监测的角度
无菌制剂生产应在受控环境中进行,同时需定期对环境进行清洁、消毒和检测。环境监测是确认环境控制状态的关键工具,也是判断清洁、消毒效果的基础。当环境洁净度不能满足要求时,如微生物污染显著变化,可能反应清洁消毒措施的失效或者外部环境新增的挑战等,因此,需考虑调整清洁消毒方案[12]。
污染控制策略( CCS) 也将生产中微生物相关污染的识别、评估和控制提升到了一个系统性的新高度。因此,企业内部定制一个科学可靠的、设计精良的验证方法,以及日常生产中有科学的监测系统,也更代表了其对洁净生产环境的有效控制能力,以及对于环境的检测和预判。
4. 1. 5 监测手段
药企可以基于风险的评估,对于过滤后消毒剂的无菌性进行周期性的检测,以判定是否达到了使用要求等。无菌检查方法应经过方法学验证。每季度对于过滤后 A/B 级的消毒剂取样进行无菌检测( 无菌性的结果也是对消毒剂与过滤器的化学兼容性的一项反应) 。
基于合适的除菌级过滤器的选择、消毒剂的作用、配制过程中用水要求等,使得配制后消毒剂内含有的微生物负载比较低。那么使用灭菌后除菌级过滤器,对于配制后消毒剂内潜在微生物的去除,能够起到保障作用( 前提,使用后的完整性测试结果需要通过) 。
除菌效果的评估,对应过滤器验证中的细菌截留测试的情况,基于上述的分析,在消毒剂除菌过滤过程中,其风险低。同时加上体系化的环境控制策略以及合适的检测手段,对于消毒剂使用的过滤器无需特定要求做两者之间的细菌截留测试。
4.2化学兼容性风险
评估消毒剂与所选滤器材质之间的适用性。更多的是关注消毒剂与过滤器的化学兼容性。从图 1 可知,一个完整的过滤器的构成除了包含核心膜材、还包括支撑层、内外骨架以及 O-型圈等。化学兼容性试验应涵盖整个过滤装置,不只是滤膜[4]。换言之,需要对于消毒剂与所选过滤器 (整个装置) 之间是否兼容进行评估证明。

图 1 摘自 PDA 26#技术报告 液体除菌过滤[9]
化学兼容性是评估消毒剂与所用过滤器是否适用的重要思考维度。需要对实际使用条件下( 在特定的参数条件下,接触了特定的时间) 的消毒剂与过滤器进行适当的验证,每次使用后的过滤器符合该要求。因每次过滤操作执行结束后,此时的过滤器与消毒剂,均经过了前处理条件、消毒剂种类的影响、过滤参数影响或者适当的储存条件的影响等因素条件; 将对于目视检查、完整性测试以及过滤后消毒剂监测的角度进行展开,评估两者之间的兼容性:
4. 2. 1 目视检查
目视检查是一种非常直观且明显能够判定过滤液与过滤器是否兼容的指标。因此,可以通过对每次使用后的过滤器进行目视检查,观察整个过滤器是否有外观上的明显变化。
如 O 型圈的变化、过滤器是否有开裂、溶胀、变形等;
4. 2. 2 完整性测试
在过滤后进行完整性检测是重要的,可以发现可能在过滤过程中发生的任何过滤器泄漏或穿孔。完整性测试对于泄露的风险以及消毒剂与过滤器之间的化学兼容性的情况起到了重要的提示作用。
在该案例中,可以对于每次使用后的过滤器,基于过滤器供应商提供的完整性测试方法( 泡点法或扩散流等) 以及限制标准进行测试。完整性测试是一种非破坏性的方法,是可以从微观上证明整个过滤器结构的完好的重要指标。
过滤后对于过滤器的完整性测试的结果,能够识别到过滤过程中任何过滤器的泄露或穿孔[6]。即此测试手段能够表明在使用过程中,过滤器是否损坏。因此,其对除菌级过滤器的化学兼容性进行判断是适当且重要的[12]。
4. 2. 3 监测手段
如果两者存在不适用或者兼容性问题,可能会导致过滤器诸如纤维脱落或者是滤膜的微观结构破坏等问题,从而对于过滤后消毒剂的状态产生影响。
因此,可以通过对于过滤后消毒剂的合适检测来识别相关的风险,例如澄明度、无菌检测等。
基于上述信息,目视检查合格下的过滤器,如果完整性测试能够通过,且过滤后的消毒剂能够满足相关指标要求就能判定两者之间化学兼容性的通过。
4.3提取浸出风险
提取物研究整体原则需要基于实际情况进行,合理且适度,不应过度研究[13]。从消毒剂的使用场景分析消毒剂需要作用于物体表面,在洁净区内通常如操作台面或者是其他操作区域表面的消毒处理,并不会和终产品有直接接触。对应药物产品过滤器验证中的提取物浸出测试( E&L) 不需要进一步研究。
但在实际情况中需要考虑消毒剂的挥发对产品质量的影响,必要时消毒后与生产时间间隔应以及消毒剂的残留等进行评估。
4.4吸附性风险
如果配制后的消毒剂采用除菌过滤器进行过滤,可能对消毒剂有效成份产生吸附作用,即会影响消毒剂的浓度,进而影响消毒效力[14]。所以消毒剂的除菌过滤过程应作为消毒效力验证的最差条件进行考虑。消毒效力验证使用的消毒剂应是除菌过滤的或无菌的,不应有外来微生物干扰效力验证结果。
5、验证内容
基于前文的分析,在制定企业内对消毒剂过滤器的控制及管理具体要求时,需要进行风险评估,对过程中失效因素进行识别,通过失效的严重性、可能性及可检测性进行评估,以确定最终的验证输出或者检测手段[15]。
对于药企制备的消毒剂溶液,需要对其质量负责,即需要证明相关消毒剂溶液可以达到污染控制的要求。
A/B 级环境所用的无菌消毒剂需要满足的制备要求: 那么过滤器前后处理、完整性测试,滤前微生物限度检测、滤后的无菌检测、设备的灭菌以及有效期的验证等。另外对于需要加水对消毒剂进行稀释的,水质要求及相应水点的管理也需要评估。
如果配制的非无菌产品,则需要进行生物负载测试、有效期验证等。
综上所述,客户在对于实际消毒剂使用过程中,可以通过对于过滤器的目检的状态、完整性数值、过滤后消毒剂的状态等进行综合评估两者适用性,并形成特定的内部评估文件。
6、结论
从污染控制策略( CCS) 的整体视角,不可否认清洁和消毒是其中是一个非常重要的环节,企业对于需要除菌过滤的消毒液与过滤器之间需要对于两者之前的适用性进行考察。
参考文献
[1] NMPA GMP 附录 1 无菌药品[S]. 2010.
[2] EU GMP Annex-1 Manufacture of Sterile Medicinal Products[S].2022.
[3] PDA TR 70# Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities[R].2015.
[4] NMPA《除菌过滤技术及应用指南》[R].2018.
[5] ICH Q9 Quality Risk Management[R].2006.
[6] FDA Guidance for Industry-Sterile Drug Products Produced by Aseptic Processing-Current GMP[S].2004
[7] ASTM F838 Standard Test Method for Determining Bacterial Retention of Membrane Filters Utilized for Liquid Filtration. [S].2020 年修订.
[8] 张晗,郑向文: 药品生产所用的塑料组件之过滤器风险评 估的思考及实例[J].中国检验检测,2021( 3) : 60-63
[9] PDA TR 26# Sterilizing Filtration of Liquids[R]. 2008.
[10]《消毒剂技术规范》[R]. 2008.
[11] 中华人民共和国国家卫生健康委员会 WS 628-2018 《消毒产品卫生安全评价技术要求》,2018.
[12] 国家药品监督管理局食品药品审查检验中心 组织编 写《药品 GMP 指南 无菌制剂( 上册) 》[M]. 2023.
[13] 胡延臣. 王亚敏( CDE) 《化学药品注射剂生产所用塑 料组件系统相容性研究思路浅析》[J].中国药学杂 志,2022.
[14] GB/T 38502-2020《消毒剂实验室杀菌效果检验方法》 [S].
[15] 戴福文《基于 FMEA 的检测实验室风险评估与对应》 [J]. 中国检验检测,2020( 01) .
本文作者王红1 李鹏1 闫博2 王刚2,1. 上海格氏流体设备科技有限公司; 2. 长春金赛药业有限责任公司,来源于中国检验检测杂志,仅供交流学习。

来源:Internet


