您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-16 16:40
雅培公布Aveir的Leadless II IDE 最新研究结果,并且FDA正式开始审查研究结果,一旦获得批准,可以为需要使用起搏器来治疗缓慢心律的患者提供新的好处。
Leadless II IDE 研究评估了 Aveir 无线起搏器在心律异常患者中的应用。研究数据显示 Aveir 达到了其预先指定的主要终点。
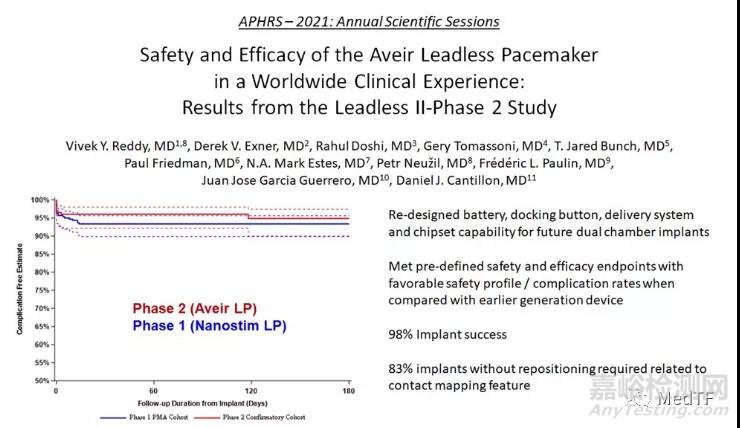
Leadless II 在美国、加拿大和欧洲的 43 个中心招募的 200 名患者,随访周期为六周,并对主要安全性和有效性终点进行分析。结果显示:
98% 的患者成功植入了 Aveir。
在植入后六周,96% 的患者无严重并发症,95.9%患者达到可接受的治疗效果。
在 96% 的临床病例中,医生能够在第一次或者通过一次重新定位,即可准确定位植入。
Aveir
Aveir是目前为止第三款成熟无线起搏器,前两款为分别为美敦力的Micra VR 和 Micra AV 。Aveir旨在提高心室节律-仅在需要需要时才触发电脉冲,以使缓慢的心脏重回正轨,而不是保持恒定的频率。Aveir螺旋式锚定设计,可以允许医生在电池耗尽时,通过静脉快速取出,无需开胸。
Aveir前身为Nanostim,是圣犹达在13年收购,在15年随圣犹达加入雅培大家庭。当然Nanostim由于质量问题(电池提前耗竭、按钮(Docking Button)脱落)发布了医疗器械召回,目前全球已停止植入 NanoStim。
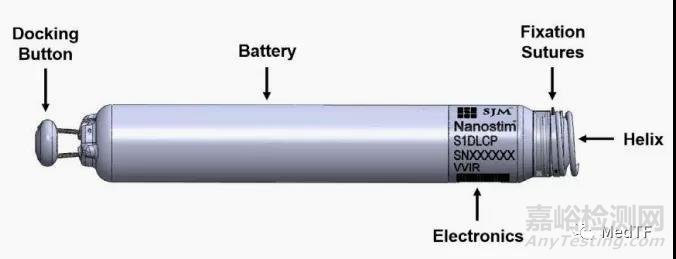
因此雅培对Nanostim进行升级优化,最终衍化成为Aveir。根据雅培心律管理高级副总裁Randel Woodgrift介绍:Aveir 是一款具有更长电池寿命的起搏器(电池寿命长达12至13年),Aveir植入后可以回收,并允许通过微创植入手术。
根据雅培介绍Aveir主要克服了Nanostim电池不稳定、按钮脱落,至于其它优势和Nanostim类似。
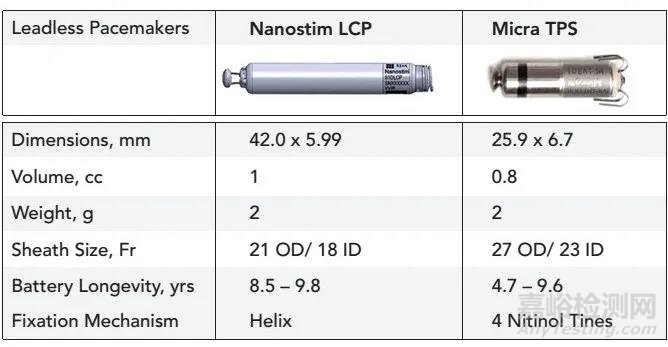
从已公开信息看Aveir相对于美敦力的Micra并没有太多优势,而美敦力的Micra多年来以及植入7万多套Micra系列产品,充分验证Micra的安全性有效性,这使得美敦力在无线起搏器领域一骑绝尘。
尽管Aveir对Micra没有什么明显优势,但是无线起搏器市场足够大。凭借着雅培的在市场销售能力,有望占领部分市场。有了市场后,可以对Aveir进一步升级优化,使下一代有望超越Micra。

来源:MedTF


